
【题目】(1)3.6 g H2O的物质的量是________,含有____________________________个水分子,含有________mol H。
(2)11.7 g NaCl的物质的量是________,含有____________个Na+,________________个
Cl-,共含离子________mol。
(3)3.01×1022个OH-的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________,这些OH-与________mol NH3的质量相同,和________g Na+含有的离子数相同。
【答案】(1)0.2 mol 0.2×6.02×1023 0.4
(2)0.2 mol 0.2×6.02×1023 0.2×6.02×1023 0.4
(3)0.05 mol 0.85 g 0.45 mol 0.5 mol 0.05 1.15
【解析】(1)n(H2O)=![]() =0.2 mol,N(H2O)=
=0.2 mol,N(H2O)=![]() =0.2×6.02×1023,一个水分子含有2个氢原子,故含有的氢原子的数目为2×0.2mol=0.4mol。
=0.2×6.02×1023,一个水分子含有2个氢原子,故含有的氢原子的数目为2×0.2mol=0.4mol。
(2)n(NaCl)=![]() =0.2 mol。0.2mol中含有0.2×6.02×102个Na+和0.2×6.02×1023
=0.2 mol。0.2mol中含有0.2×6.02×102个Na+和0.2×6.02×1023
Cl-,两者共0.4摩尔。
(4)n(OH-)=![]() =0.05mol,m(OH-)=n(OH-)×M(OH-)=0.05mol×
=0.05mol,m(OH-)=n(OH-)×M(OH-)=0.05mol×![]() = 0.85 g,一个OH-含有的质子数为9个,电子数目为10个,则0.05 mol OH-含有的质子数目为 0.05mol×9=0.45 mol,电子的数目为0.05mol×10=0.5 mol,OH-与NH3的摩尔质量相同,质量相同的两种物质的物质的量一定相同,故0.05 mol OH-与0.05 mol NH3的质量相同。m(Na+)=
= 0.85 g,一个OH-含有的质子数为9个,电子数目为10个,则0.05 mol OH-含有的质子数目为 0.05mol×9=0.45 mol,电子的数目为0.05mol×10=0.5 mol,OH-与NH3的摩尔质量相同,质量相同的两种物质的物质的量一定相同,故0.05 mol OH-与0.05 mol NH3的质量相同。m(Na+)=![]() ×23
×23![]() =1.15 g。
=1.15 g。


科目:高中化学 来源: 题型:
【题目】要配制450mL 0.2molL﹣1FeSO4溶液,实验操作步骤有:
①在天平上称取a g绿矾(FeSO47H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解;
②将所得溶液沿玻璃棒注入容量瓶中;
③继续向容量瓶中加水至液面距刻度线1﹣2cm处,改用胶头滴管滴加蒸馏水至凹液面底部与刻度线相切;
④用少量水洗涤烧杯和玻璃棒2﹣3次,每次洗液都转入容量瓶;
⑤将容量瓶塞紧,充分摇匀.
填写下列空白:
①a g绿矾的实际质量为 g.
②上述操作步骤的正确顺序为 .
③下列操作会使所配溶液的浓度偏高的是 .
A.若配制时遗漏步骤④; |
B.定容时俯视刻度线; |
C.称量时物、码放反了; |
D.绿矾样品已部分风化; |
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切;
F.引流时玻璃棒靠在刻度线上方.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上.
①金刚石与C60;②O2与O3;③16O、17O和18O;
④CH4和CH3CH2CH3;⑤乙烯和乙烷;⑥葡糖糖和果糖
⑦![]() 和
和![]() ;⑧
;⑧![]() 和
和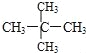 ;
;
(1)互为同位素的是 ;
(2)互为同素异形体的是 ;
(3)互为同系物的是 ;
(4)互为同分异构体的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
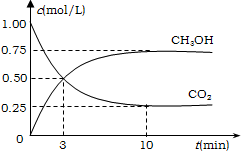
(1)从反应开始到平衡,氢气的平均反应速率v(CO2)= ________mol/(Lmin);
(2)氢气的转化率= ________;
(3)求此温度下该反应的平衡常数K=________;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1mol CO2和3mol H2
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,待反应再一次达到平衡后,CO2的物质的量浓度为c2,则c1________ c2(填>、<、=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有流失的生产用料、中间产物和产品,以及生产过程中产生的污染物。随着工业的迅速发展,废水的排放量迅速增加,严重威胁人类的健康和安全,工业废水的处理比城市污水的处理更为重要。下图是含铬工业废水和含氰废水的处理流程:
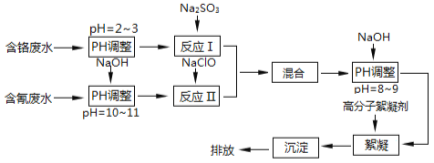
请回答下列问题:
(1)电镀废水中的铬主要以CrO42—形式存在,其中Cr元素的化合价为 。
(2)酸性条件下,CrO42—极易被还原剂还原为毒性较小的Cr3+。图中“反应Ⅰ”的离子方程式为 。
(3)pH>10时,“反应Ⅱ”中的NaClO可快速地将氰离子(CN—)氧化为无毒的两种物质,这两种物质是 、 (写化学式);若pH<8.5,则生成剧毒的CNCl气体(沸点13.1℃),写出该反应的离子方程式 。
(4)经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合的目的是 。
(5)含氰废水及含铬废水可以通过电化学的方法进行无害化处理。
①可采用惰性电极对含氰废水进行电解,氰离子在碱性条件下被氧化为无毒的物质,该电解工艺中,阳极电极反应式是 。
②电解法处理酸性含铬废水(若铬元素以Cr2O72—形式存在)时,以铁板和石墨作电极,处理过程中存在反应Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。则阳极的电极反应式为 ,当有1 mol Cr2O72—被还原时,电路中转移的电子为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
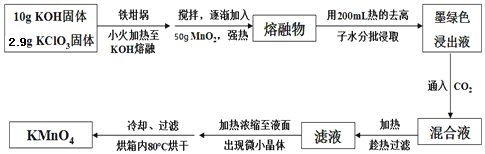
回答下列问题:
(1)实验中采用 (填“铁坩埚”或“瓷坩埚”)加热KOH和KClO3固体混合物。
(2)熔融时,MnO2转化为K2MnO4,KClO3转化为KCl,其反应的化学方程式为 。
(3)几种物质的溶解度曲线如图所示。
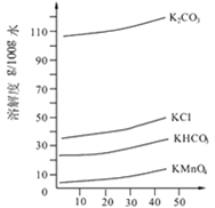
①通入CO2至pH为10~11,K2MnO4转化为KMnO4和MnO2。其反应的离子方程式为 。
②不能通入过量CO2的原因是 。
(4)趁热过滤的目的是 ;用冷水洗涤KMnO4晶体较好的原因是 。
(5)计算经过上述转化,最多可制得KMnO4的质量为 (结果保留2为小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
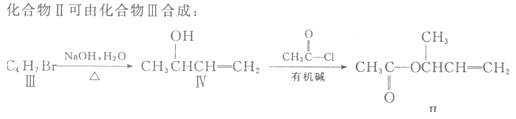
【题目】过渡金属催化的新型碳碳偶联反应是近年来有机合成的研究热点之一,如:
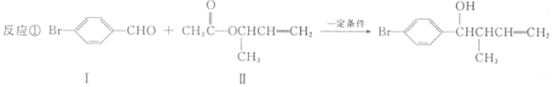
(1)化合物I的分子式为 。
(2)化合物Ⅱ与Br2加成的产物的结构简式为 。
(3)化合物Ⅲ的结构简式为 。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为 因此,在碱性条件下,由Ⅳ与CH3CO--Cl反应合成Ⅱ,其反应类型为 。
(5)Ⅳ的一种同分异构体V能发生银镜反应。V与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为 (写出其中一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com