


科目:高中化学 来源: 题型:
| A、向CaCl2溶液中通入CO2:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B、硫酸与氢氧化钡溶液反应:SO42-+Ba2++H++OH-=BaSO4↓+H2O |
| C、醋酸和氨水混合:CH3COOH+OH-=CH3COO-+H2O |
| D、石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
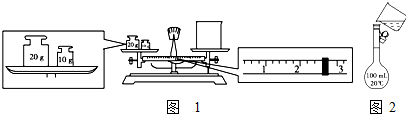
查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是(双选)( )
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是(双选)( )| A、A分子属于酯类化合物,在一定条件下能发生水解反应 |
| B、A在一定条件下可与4 mol H2发生加成反应 |
| C、符合题中A分子结构特征的有机物只有1种 |
| D、与A属于同类化合物的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
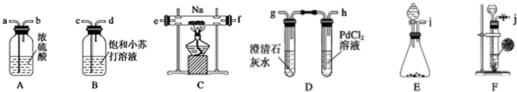
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
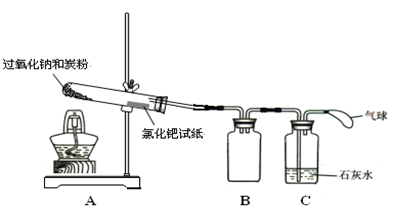
| ||
2- 3 |
- 3 |
2- 3 |
- 3 |
2- 3 |
- 3 |
2- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com