
【题目】(选修3物质结构与性质)(15分)
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
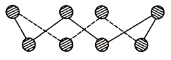
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离
子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 ;
(4)H2Se的酸性比H2S (填“强”或“弱”)。气态SeO3分子的立体构型
为 ,SO32-离子的立体构型为 ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,
K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
;
② H2SeO4比 H2SeO3酸性强的原因:
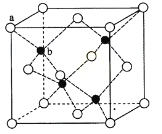
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为 (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为 pm(列示表示)
【答案】(1)SP3
(2)O>S>Se
(3)34 3s23p63d10
(4)强 正四面体 平面三角形
(5)①H2SeO4和H2SeO3第一步电离产生的氢离子抑制第二步电离,所以第一步电离程度大于第二步电离程度。
②对同一种元素的含盐酸来说,该元素的化合价越高,其含氧酸的酸性越强。
(6)4.1
【解析】
(1)因为S8为环状立体结构,键角为120°,所以轨道杂化方式为SP3。
(2)根据同主族电离能变化规律,O、S、Se原子的第一电离能由大到小的顺序为O>S>Se.(3)Se原子序数为34,其核外M层电子的排布式为3s23p63d10(4)原子半径越大,氢化物越容易电离出氢离子,所以H2Se的酸性比H2S强。气态SeO3分子的立体构型为正四面体,SO32-离子的立体构型为平面三角形。(5)①H2SeO4和H2SeO3第一步电离产生的氢离子抑制第二步电离,所以第一步电离程度大于第二步电离程度。



 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O + Zn + H2O═2Ag + Zn(OH)2 ,示意图如下。下列判断正确的是( )
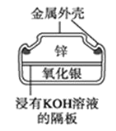
A.锌为负极,被还原
B.纽扣电池工作时,OHˉ移向Ag2O
C.每6.5 g 锌发生反应时,转移电子0.1 NA
D.纽扣电池工作时,电解质溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
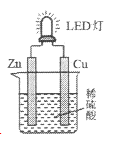
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】注意分析下列两条信息,它们可能有助于你解答下面的推断题:
①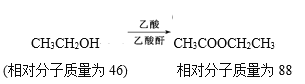
②有机化合物分子中,同一个碳原子上连接两个羟基的结构是不稳定的,易自动失去一分子水,如
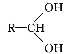
![]()
![]() +H2O(R—代表烃基)
+H2O(R—代表烃基)
现有只含C、H、O三种元素的化合物A~F,它们的某些有关信息已注明在下面的方框内。
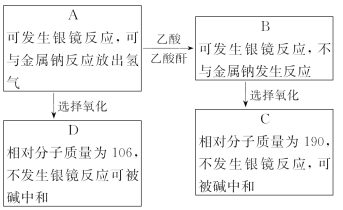
请推断出化合物A、B、C、D的结构简式。
A______________,B______________,C______________,D______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是( )
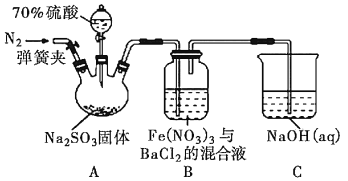
A.装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO![]()
B.实验室中配制加70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C.三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3:
![]()
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=______,该反应中的![]() ____0(填“>”“<”或“=”)。
____0(填“>”“<”或“=”)。
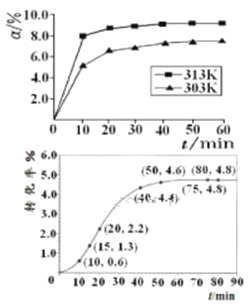
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(1)发生反应,N2转化率随时间(t)变化如图。15-20min内,v(NH3)=____。若其他条件不变,在图中画出使用催化剂后N2的转化率随反应时间变化的曲线示意图_______。
(2) 25℃时,某同学将0.lmol![]() 盐酸与0.2 mol
盐酸与0.2 mol![]() 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中c(NH4+)______c(NH3
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中c(NH4+)______c(NH3![]() H2O)(25℃时,NH3.H2O的电离常数
H2O)(25℃时,NH3.H2O的电离常数![]() )
)
(3) 25℃时,向0.lmol![]() 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol![]() 氨水,有白色沉淀生成,向反应后的浊液中,继续加入0.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入0.lmol![]() 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月桂烯(![]() )是重要的化工原料,广泛用于香料行业。
)是重要的化工原料,广泛用于香料行业。
(1)月桂烯与足量氢气完全加成后生成A,A的名称是_________________________;
(2)以月桂烯为原料制取乙酸香叶酯的流程如下图:
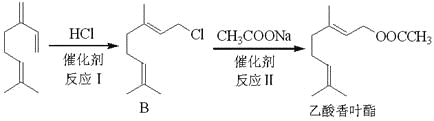
①B中官能团的名称______________________;
②乙酸香叶酯的化学式____________________;
③反应Ⅰ的反应类型是____________________;
④反应Ⅱ的化学方程式是__________________________________________________;
(3)已知:烯烃臭氧化还原水解反应生成羰基化合物,如:

一定条件下,月桂烯可实现如下图所示转化(图中部分产物已略去):
![]()
①C与新制的Cu(OH)2悬浊液反应的化学方程式为:
_______________________________________________________________;
②E在一定条件下能发生缩聚反应,写出其产物的结构简式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代社会应用最广泛的能源之一
(1)某原电池装置如图所示:

①其中,Zn电极为原电池的____ 极,电极反应式是_________________。
②Cu电极上发生的反应属于______(填“氧化”或“还原”)反应,当铜表面析出4.48 L氢气(标准状况)时,导线中通过了______ mol电子。
(2)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示:

请回答下列问题:
①电极X的材料是______; 正极上发生的电极反应式为____________;
②当导线中通过了0.1mol电子时,银棒增重______ g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质.本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。

(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为_____________。
(2)写出木屑水解反应的化学方程式:___________
配平浸出步骤反应方程式C6H12O6+MnO2+H2SO4→MnSO4+CO2+H2O_________________
(3)若取消除酸操作步骤,将会产生气体_____________(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式____;
(5)取一定量的阳极泥进行实验分析,得到如图象。硫酸的最合适用量为________mL,若再增加硫酸的用量,将会导致____________(填化学式)的消耗量增大。

(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于_________L。(假设阳极泥中的其它成分不参与反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com