
X、Y、Z、W、T是原子序数依次增大的前四个周期的元素,其中有两种是金属元素。其相关信息如下表:
| 元素 | 相关信息 |
| X | X一种核素在考古时常用来坚定一些文物的年代 |
| Y | Y基态原子的s轨道电子与P轨道电子数相等 |
| Z | Z是所在周期的单核离子中半径最小 |
| W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T | T有多种化合物,其白色氢氧化物在空气中会迅速变为灰绿色,最后变为红褐色 |
(1)O>C>Al H—O
(2)[Ar]3d6 3Fe+4H2O(g) Fe3O4+4H2 SiO2 + 2C
Fe3O4+4H2 SiO2 + 2C  Si + 2CO↑
Si + 2CO↑
(3)H2O2 H2O2分子间存在氢键
(4)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)H=1520.0KJ/mol.
解析试题分析:(1)根据题目提供的信息可推知:X是C;Y是O;Z是Al;W是Si;T是Fe。元素的原子半径越小,元素的非金属性越强,其电负性就越大。在Al、C、O三种元素中非金属性强弱顺序为O>C>Al。所以电负性O>C>Al。元素的非金属性越强,其与H形成的共价键的极性就越强。因此在C—H和H—O键中极性强的是H—O。(2)26号元素Fe失去2个电子后此外层变为最外层。电子排布式为1s22s22p63s23p63d6.或写为[Ar]3d6。高温下Fe与水蒸气反应的方程式为3Fe+4H2O(g) Fe3O4+4H2。在工业上用SiO2于焦炭制取Si的方程式为SiO2 + 2C
Fe3O4+4H2。在工业上用SiO2于焦炭制取Si的方程式为SiO2 + 2C  Si + 2CO↑。(3)C2H2、H2O2都是由分子晶体构成的物质。前者是非极性分子,后者是极性分子。由于H2O2的分子间除了存在一般的分子间作用力外,还存在着氢键,增加了分子之间的相互作用。克服这种分子间作用力使物质熔化或气化消耗的能量就更大,所以沸点H2O2比C2H2高。(4)根据题意可写成该反应的热化学方程式为SiH4(g)+ 2O2(g)=SiO2(s)+2H2O(l)H=1520.0KJ/mol.。
Si + 2CO↑。(3)C2H2、H2O2都是由分子晶体构成的物质。前者是非极性分子,后者是极性分子。由于H2O2的分子间除了存在一般的分子间作用力外,还存在着氢键,增加了分子之间的相互作用。克服这种分子间作用力使物质熔化或气化消耗的能量就更大,所以沸点H2O2比C2H2高。(4)根据题意可写成该反应的热化学方程式为SiH4(g)+ 2O2(g)=SiO2(s)+2H2O(l)H=1520.0KJ/mol.。
考点:考查元素的推断、共价键、电负性的比较、原子的电子排布式的书写、化学方程式、热化学方程式的书写的知识。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:填空题
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子; B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 ,D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: _______________。
(3)A、B两元素形成化合物属 (“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: ________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
原子序数小于36的四种元素X、Y、Z、W,有关它们的信息如下表所示:
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子排布在三个能级上,且有三个电子能量相同 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的最外层电子数等于次外层电子数的2倍 | Y是形成化合物种类最多的元素 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W的一种核素质量数为52,中子数为28 | +6价W的化合物有强氧化性,可用于皮革加工、吹气法检查司机是否酒驾等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。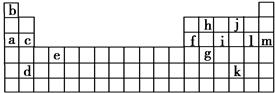
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。
核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力
B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| | 锂 | X | Y |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | —— | 9 550 | 11 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示四种微粒:A________,B________,C________,D________。
(2)写出A、B、E三种微粒反应的离子方程式:____________________________________________________。
Ⅱ.(1)CH3+、CH3-、CH3-都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH3+中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N3-叫做叠氮离子,请写出由三个原子构成的含有与N3-的电子数相同的粒子的化学式(3种)________、______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)19世纪末,人们开始揭示原子内部的秘密,最早发现电子的科学家是________。
(2)道尔顿的原子学说曾起了很大的作用。他的学说包含下列三个论点:①原子是不能再分的粒子,②同种元素的原子的各种性质和质量都相同,③原子是微小的实心球体。从现代的观点看,你认为三个论点中不确切的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学家发现:具有2、8、20、28、50、82、114、126等数目的质子或中子的原子核具有特别的稳定性,并将这些偶数称为“幻数”,而具有双幻数的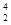 He、
He、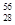 Ni、
Ni、 Sn、Pb等尤为稳定。根据此信息回答下列问题:
Sn、Pb等尤为稳定。根据此信息回答下列问题:
(1)写出前三种质子数为“幻数”的元素原子的结构示意图,并标明元素符号__________________。
(2)已知氧有三种同位素 O、
O、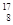 O、
O、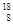 O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
(3)根据现有元素周期律推算,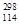 R位于元素周期表的第________周期第________族,核稳定性
R位于元素周期表的第________周期第________族,核稳定性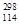 R__________
R__________ R(填“>”、“<”或“=”)。
R(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。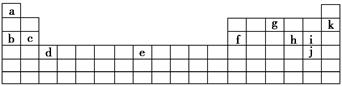
用上表中的字母代号回答下列问题:
(1)属于卤族元素的有_________________________________________;
(2)属于稀有气体元素的有_____________________________________;
(3)属于第ⅠA金属元素的有___________________________________;
(4)写出c元素在周期表中的位置_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有七种短周期主族元素,其原子序数按A、B、C、D、E、F、G的顺序递增。A元素的最高正化合价和最低负化合价的代数和等于0,且A是形成化合物种类最多的元素;C原子能形成分别含10电子、18电子的两种阴离子,且C与F位于同一主族;D单质投入冷水中反应缓慢,投入沸水中迅速产生气泡;E的简单阳离子是同周期元素所形成的简单离子中半径最小的。回答下列问题:
(1)B位于周期表第________周期第________族。
(2)A、B、C三种元素能形成等电子体,请写出其中一组等电子体:________________________________________________________________________。
(3)元素M位于E与F元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池。M、F、G的气态氢化物的稳定性由强到弱的顺序为______________(用化学式表示)。
(4)若选择三种试剂设计实验能证明非金属性:B>A>M,用化学方程式表示实验原理:__________________________________________________。
(5)A、M、F、G的最高价氧化物对应水化物的酸性由强到弱的顺序为________________________(用化学式表示)。
(6)下列实验方法能证明D与E的金属性强弱关系的是________(填字母序号)。
A.比较D和E的单质分别与稀硫酸反应产生气泡的快慢
B.比较D和E的单质分别与同浓度的氢氧化钠溶液反应产生气泡的快慢
C.比较D和E的单质分别与氯气、氧气、硫等非金属单质反应的产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com