
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
科目:高中化学 来源:2015-2016学年江西省高一上第二次月考化学试卷(解析版) 题型:填空题
Ⅰ.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号) 。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是 (填代号)。
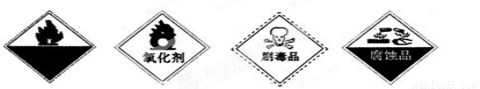
A.自燃物品 B.氧化剂 C.剧毒品 D.腐蚀品
Ⅱ某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下:
实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4,溶液立即变蓝;
实验②:向实验①的溶液中加入4 L 0.5 mol/L的Na2SO3溶液,发生反应如下
SO32-+ I2+H2O→SO42-+I-+H+(未配平),恰好完全反应。
(1)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)写出实验①中发生反应的离子方式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一上学期期中考试化学试卷(解析版) 题型:选择题
实验室需用480mL0.5mol/L的NaOH溶液,,以下操作正确的是
 A.称取10.0gNaOH,加入500mL水
A.称取10.0gNaOH,加入500mL水
B.称取10.0gNaOH,选取500mL容量瓶进行配制
C.称取9.6gNaOH,选取480mL容量瓶进行配制
D.称取9.6gNaOH,选取500mL容量瓶进行配制
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:填空题
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
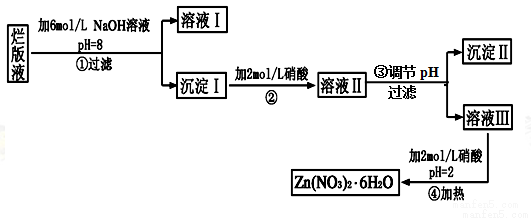
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
生成氢氧化物沉淀的pH
Fe(OH)3 | Zn(OH)2 | |
开始沉淀时 | 1.5 | 8.0 |
完全沉淀时 | 2.8 | 11.1 |
注: 金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)“烂版液”中溶质的主要成分是Zn(NO3)2,若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中调节pH的范围是_______________;目的是_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
室温下,有关叙述正确的是
A.某物质的溶液pH <7,则该物质一定是酸或强酸弱碱盐
B. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D. pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)> c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强可使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第二次检测化学试卷(解析版) 题型:实验题
某同学以反应2Fe3++2I- 2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响。实验如下图:
2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响。实验如下图:
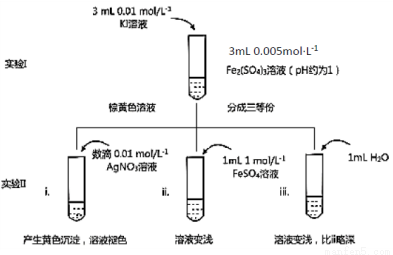
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原 因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用右图装置(a、b均为石墨电极)进行实验验证。
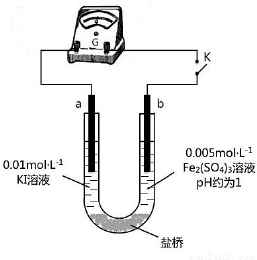
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol·L-1 AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用右图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②该实验与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期第二次诊断测试化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性: I2> Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com