
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。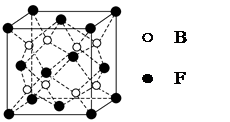
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(4)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________(只要求列出算式)。
(1)2s22p4(2分) 1s22s22p63s23p6(2分)
(2)Na3AlF6 (2分)
(3)Al2O3为离子晶体(或者;离子化合物)而AlCl3为分子晶体(或共价化合物)(3分)
(4)CaO晶体中Ca2+、O2-的带电荷大于NaCl晶体中Na+、Cl-的带电荷。(2分)
(5)CaF2(1分) 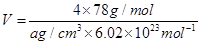 (3分)
(3分)
解析试题分析:由题干知道A、B是第二周期元素,C、D、E是第三周期元素,F是第四周期元素,同时A原子L层上有2对成对电子,则A为O,则B为F,B、C、D的核外电子排布相同的简单离子,说明C、D的阳离子也是两层,再根据CE、FA为电子数相同的离子晶体,D2A3制取D,则C为Na、D为Al、E为Cl、F为Ca。
(1)O元素的基态原子价电子排布式是2s22p4;Ca2+的含18电子,电子排布式是1s22s22p63s23p6。
(2)B为F、C为Na、D为Al可知X为Na3AlF6。
(3)工业制取铝一般不用三氯化铝而用三氧化二铝主要是Al2O3为离子晶体(或者;离子化合物)而AlCl3为分子晶体(或共价化合物);
(4)CaO晶体大于NaCl晶体的晶格能的主要原因是CaO晶体中Ca2+、O2-的带电荷大于NaCl晶体中Na+、Cl-的带电荷;次要原因是离子半径。
(5)根据Ca2+、F-的所带电荷数可以看出以1:2结合,化学式为CaF2;根据晶胞计算出含有4个Ca2+、8个F-,则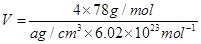 。
。
考点:本题考查元素周期表结构、元素推断、物质结构、晶体的结构与性质、晶胞的计算。


科目:高中化学 来源: 题型:填空题
a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5;C的单质跟盐酸反应,生成C3+和氢气;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构。
① 写出元素符号:A ,D ,E 。
② B、C的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出A2D的电离方程式: , 。
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。N P AS ;O S Se分别是VA族、VIA族连续三元素。
①根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度,请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③将SO2气体通入溴水恰好完全反应后,溶液中存在的离子浓度由大到小的顺序是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D代表4种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,A元素的名称是 ,该元素的原子核外共有 种不同运动状态的电子;该元素的第一电离能比后面一号元素大的原因是 。
(2)B为元素周期表中的29号元素,常与H2O、NH3等形成配合物。
B的无水硫酸盐晶体呈 色,向盛有B的硫酸盐水溶液的试管里逐滴加入氨水,首先形成 ,继续添加氨水,沉淀溶解得到 ,写出后一步反应的离子方程式 。
(3)C元素的负一价离子的电子层结构与氩相同,C的最高价氧化物的水化物的化学式为 。
(4)A元素的最高价氧化物对应的水化物的稀溶液与29号元素的单质反应的离子方程式是____________________。
(5)D元素在元素周期表的各元素中,电负性仅小于氟,A的最低价氢化物与D的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、T、W五种元素的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。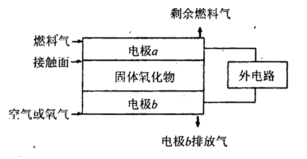
①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若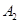 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。
④若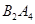 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F是元素周期表前四周期的六种元素,原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| A | 原子的核外电子数和电子层数相等 |
| B | 基态原子价电子排布为nsnnpn |
| C | 气态氢化物与最高价氧化物的水化物反应生成盐 |
| D | 基态原子电子排布有2个未成对电子 |
| E | 位于第三周期,在同周期中原子半径最大 |
| F | 与B 形成的合金为目前用量最多的金属材料 |
 2CA3△H<0,反应10min达到平衡,生成0.2molCA3。
2CA3△H<0,反应10min达到平衡,生成0.2molCA3。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
写出10电子微粒
①原子__ ___② 分子___________________________
③ 阴离子______________________④ 阳离子_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com