


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
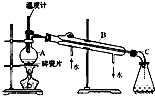 (1)实验室分馏石油的正确操作顺序是:A→
(1)实验室分馏石油的正确操作顺序是:A→查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间 \CO转化率 \温度 |
1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷(带解析) 题型:填空题
(12分)Ⅰ.煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即 。
(2)上述四个热化学方程式中ΔH>0的反应有 。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是 。
| A.a比b多 | B.a比b少 | C. a与b在理论上相同 | D.两者无法比较 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉二中高二下学期期中考试化学试卷(带解析) 题型:实验题
在实验室里用乙醇和浓硫酸反应生成乙烯,再用溴与乙烯反应生成1,2-二溴乙烷,可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:
| | 乙醇 | 1,2二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
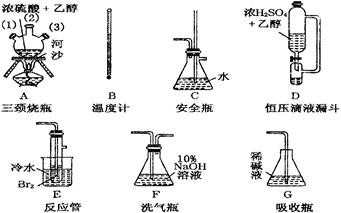
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com