
| A. | 标准状况下,33.6LSO3中含有原子数为6NA | |
| B. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,2.24L氧气与足量镁粉充分反应,转移电子数为4NA | |
| D. | 117g氯化钠固体中含有2NA个氯化钠分子 |
分析 A、标况下三氧化硫为固体;
B、乙烯和环丁烷的最简式均为CH2;
C、常温常压下气体摩尔体积大于22.4L/mol;
D、氯化钠为离子晶体.
解答 解:A、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和含有的原子个数,故A错误;
B、乙烯和环丁烷的最简式均为CH2,故28g混合物中含2molCH2,故含2NA个碳原子,故B正确;
C、常温常压下气体摩尔体积大于22.4L/mol,故2.24L氯气的物质的量小于0.1mol,故转移的电子数小于0.2NA个,故C错误;
D、氯化钠为离子晶体,由钠离子和氯离子构成,不含氯化钠分子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3OH | B. | CH3COOH | C. | CH3COOCH2CH3 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化的硝酸银溶液,有白色沉淀产生,一定有Cl- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红,一定有NH4+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧,火焰呈黄色,说明原溶液中一定不含有K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐之间发生的反应一定属于复分解反应 | |
| B. | AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl溶解度比Ag2S大 | |
| C. | 根据分散系是否具有丁达尔现象可将分散系分为溶液、胶体和浊液 | |
| D. | NH3溶于水后所得的溶液可以导电,所以NH3为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率增大,逆反应速率减小 | |
| B. | 若正反应是放热反应,则A为气态 | |
| C. | 物质A一定为非气态,且正反应是吸热反应 | |
| D. | 若向容器中充入稀有气体,则平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+Cu2+═Fe2++Cu | |
| B. | Cl2+H2O═HCl+HClO | |
| C. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| D. | 4HCl+MnO2═MnCl2+Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
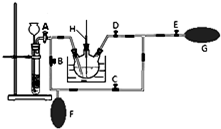 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成的水11g,其中所含的中子数为5NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| C. | 常温常压下,48gO2和O3混合气含有的氧原子数为3NA | |
| D. | 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子数均约为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| C. | 若M+和R2-的核外电子层结构相同,则原子序数:R<M | |
| D. | 主族元素的最高正化合价等于该元素原子的核外电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com