
分析 先根据n=$\frac{m}{M}$计算出0.4g氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算出氢氧化钠的浓度,从而可知氢氧根离子浓度;然后结合水的离子积计算出该溶液中氢离子浓度,再根据pH=-lgc(H+)计算出其pH;溶液具有均一性,则取出的溶液pH不变,据此进行解答.
解答 解:0.4g氢氧化钠的物质的量为:$\frac{0.4g}{40g/mol}$=0.01mol,该溶液的浓度为:$\frac{0.01mol}{0.1L}$=0.1mol/L,NaOH为强电解质,则氢氧根离子浓度为0.1mo/L;
该溶液中氢离子浓度为:c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{0.1}$mol/L=1×10-13mol/L,该溶液的pH═-lgc(H+)=13;
溶液具有均一性,则从该溶液中取出10mL,取出溶液的pH仍然为13,
故答案为:0.1mol/L;1×10-13mol/L;13;13.
点评 本题考查了溶液pH的计算、溶液性质,题目难度不大,明确溶液酸碱性与溶液pH的计算方法为解答关键,注意溶液具有均一性的特点,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. |  直接蒸发氯化铁溶液获得氯化铁晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-═AgI↓ | |
| B. | NH4+的水解反应离子方程式:NH4++H2O?NH3•H2O+H+ | |
| C. | 镀铜时,阳极的电极反应式为:Cu2++2e-═Cu | |
| D. | 某反应△H<0,则该反应在任意条件下均可自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2,2-二甲基戊醇 | B. | 2,2-二甲基-4-戊醇 | ||
| C. | 1,3,3-三甲基丁醇 | D. | 4,4-二甲基-2-戊醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
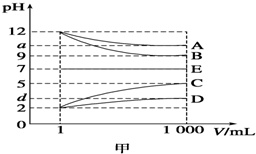 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.76×10-5 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者大于后者 | |
| B. | 可发生反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| C. | Na+、CN-、CH3COO-、HCO3-等离子能大量共存 | |
| D. | 等浓度的CH3COONa和NaCN溶液pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Fe(OH)3与HCl | D. | HNO3与KOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com