
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
分析 (1)电离常数越大,酸的电离程度越大,酸性越强;
(2)设出该醋酸的电离度,然后根据该稳定性醋酸的电离平衡常数列式计算;酸性越弱,稀释后溶液的pH变化越大;
(3)酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱;
(4)根据铵根离子的浓度和水解的影响角度来分析,如果含有对铵根离子水解起促进作用的离子,则铵根离子水解程度增大,如果含有抑制铵根离子水解的离子,则铵根的水解程度减弱,据此进行判断;
(5)等浓度的CH3COONa、NaHCO3的混合溶液,显碱性,CH3COONa的水解程度小于NaHCO3,则c(CH3COO-)>c(HCO3-),结合电荷守恒和物料守恒分析.
解答 解:(1)电离常数越大,酸的电离程度越大,酸性越强,由表中数据可知,酸性:H2SO3>CH3COOH>H2CO3;
故答案为:H2SO3>CH3COOH>H2CO3;
(2)0.02mol/L的醋酸在溶液中存在电离平衡:CH3COOH?CH3COO-+H+,设该溶液中醋酸的电离度为x,则醋酸电离出的醋酸根离子、氢离子浓度为0.02xmol/L,醋酸的浓度为0.02(1-x)mol/L,根据醋酸的电离平衡常数K=1.8×10-5可知:K=1.8×10-5=$\frac{0.02x×0.02x}{0.02×(1-x)}$,解得:x=3%;
由于醋酸的酸性需小于亚硫酸,pH相同的醋酸和亚硫酸稀释相同倍数后,醋酸的pH变化大,即:醋酸的pH大于亚硫酸,
故答案为:3%;>;
(3)已知酸性:H2SO3>CH3COOH>H2CO3>HSO3->HCO3-,酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱,则CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为:CO32->SO32->CH3COO->HSO3-,
故答案为:CO32->SO32->CH3COO->HSO3-;
(4)A.NH4Al(SO4)2中的铝离子的水解对铵根的水解起抑制作用,导致铵根离子水解程度减小,铵根离子浓度较大;
B.NH4HCO3中,铵根离子的水解显酸性,碳酸氢根离子水解显碱性,铵根离子水解程度较大;
C.NH4HSO4,电离的氢离子对铵根离子的水解产生抑制作用,水解程度较小,其铵根离子浓度较大;
D.NH4NO3 中,铵根离子的水解不受硝酸根离子的影响;
E.醋酸根离子对铵根离子的水解起到促进作用,导致铵根离子水解程度大,但是水解程度比NH4HCO3小;
根据分析可知,NH4+的浓度相同时,溶质的浓度最大的是水解程度最大的,即NH4HCO3;
故答案为:B;
(5)A.CH3COONa的水解程度小于NaHCO3,则c(CH3COO-)>c(HCO3-),而且水解程度较小,所以c(CH3COO-)>c(HCO3-)>c(OH-),故A正确;
B.溶液中存在电荷守恒,即c(Na+)+c(H+)=c(CH3COO-)+c(HCO3-)+2c(CO32-)+c(OH-),故B错误;
C.CH3COONa、NaHCO3的水解程度较小,溶液中氢氧根离子的浓度较小,所以c(CH3COO-)>c(HCO3-)>c(OH-),故C错误;
D.溶液中CH3COONa、NaHCO3的总物质的量相同,由物料守恒可知:c(CH3COO-)+c(CH3COOH)=c(HCO3-)+c(CO32-)+c(H2CO3),故D错误.
故答案为:A.
点评 本题考查了弱电解质在溶液中的电离平衡、盐的水解原理的应用、离子浓度大小比较,题目难度中等,明确弱电解质的电离平衡的影响因素为解答关键,注意掌握判断电解质强弱、电离常数的概念及计算方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-1-丁烯与1-己炔 | |
| B. | 3-甲基-2-乙基-2-戊烯与3-乙基庚烯 | |
| C. | 2-甲基-1,3-丁二烯与2-戊炔 | |
| D. | 2-己炔与2,3-二甲基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列有关尼龙-1010的说法正确的是( )
,下列有关尼龙-1010的说法正确的是( )| A. | 尼龙-1010是通过加聚反应制成的 | |
| B. | 尼龙-1010是单体是H2N(CH2)10NHCO(CH2)8COOH | |
| C. | 尼龙-1010是通过缩聚反应制成的 | |
| D. | 制作舱外航天服的材料要质轻,方便在舱外行走 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
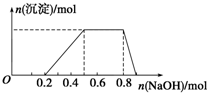 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应的特征是正反应速率和逆反应速率相等 | |
| B. | 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 | |
| C. | 在其他条件不变时,升高温度可以使平衡向放热反应方向移动 | |
| D. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com