
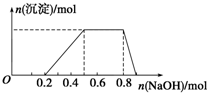
 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:分析 ①该溶液的焰色反应没有黄色,则没有Na+;
②加入NaOH溶液后,在0-0.2段没有生成沉淀,说明溶液中一定存在H+,由于后面有沉淀生成及沉淀全部溶解可知,溶液中一定存在Al3+,不存在Mg2+、Fe3+,
0.2-0.5段生成沉淀消耗了0.3mol氢氧化钠,则Al3+的物质的量为0.1mol,
0.5-0.8段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+为0.2mol;
由电荷守恒可知一定含有SO42-,根据电荷守恒计算硫酸根离子的物质的量,据此分析.
解答 解:①该溶液的焰色反应没有黄色,则没有Na+;
②加入NaOH溶液后,在0-0.2段没有生成沉淀,说明溶液中一定存在H+,由于后面有沉淀生成及沉淀全部溶解可知,溶液中一定存在Al3+,不存在Mg2+、Fe3+,
0.2-0.5段生成沉淀消耗了0.3mol氢氧化钠,则Al3+的物质的量为0.1mol,
0.5-0.8段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+为0.2mol;
由电荷守恒可知一定含有SO42-,
(1)该溶液中肯定含有的离子有H+、NH4+、Al3+、SO42-;故答案为:H+、NH4+、Al3+、SO42-;
(2)开始加入0.2 mol NaOH时,溶液无沉淀产生,说明溶液中有H+,且其物质的量为0.2 mol;因为最终沉淀完全溶解,所以溶液中无Mg2+、Fe3+,且产生沉淀和沉淀溶解所需的NaOH的物质的量为3:1,所以溶液中有Al3+且其物质的量为0.1 mol;当加入5~8 mol NaOH时,发生的反应为NH4++OH-═NH3•H2O,所以溶液中NH4+为0.3 mol,而阴离子SO42-一定含有,根据电荷守恒可知:SO42-的物质的量为0.4mol,则H+、NH4+、Al3+、SO42-的物质的量之比为0.2mol:0.3mol:0.1mol:0.4mol=2:3:1:4;
故答案为:n(H+):n(NH4+):n(Al3+):n(SO42-)=2:3:1:4;
(3)由分析可知一定不含有Na+、Mg2+、Fe3+,故答案为:Na+、Mg2+、Fe3+;
(4)氢氧化铝沉淀与氢氧化钠反应生成偏铝酸钠和水,发生的离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查了离子检验的方法应用,题目难度中等,氢氧化铝是两性氢氧化物溶于强碱是解题关键,本题难点在于如何根据图象中的数据判断铁离子的存在及根据溶液电中性判断一定存在硫酸根离子.


科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 酸雨是指pH<7.0的雨水 | |
| C. | 居室中放置一盆石灰水可以吸收CO,预防中毒 | |
| D. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2,2-二甲基戊醇 | B. | 2,2-二甲基-4-戊醇 | ||
| C. | 1,3,3-三甲基丁醇 | D. | 4,4-二甲基-2-戊醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
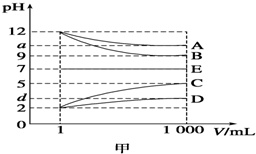 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.76×10-5 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者大于后者 | |
| B. | 可发生反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| C. | Na+、CN-、CH3COO-、HCO3-等离子能大量共存 | |
| D. | 等浓度的CH3COONa和NaCN溶液pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 样品中Fe元素的质量为2.24 g | B. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | ||
| C. | 样品中CuO的质量为4.0 g | D. | V=896 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Cl- | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①组反应当n(FeBr2):n(Cl2)≥$\frac{1}{2}$一种元素被氧化、当n(FeBr2):n(Cl2)<$\frac{1}{2}$两种元素被氧化 | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com