

| A. | 样品中Fe元素的质量为2.24 g | B. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | ||
| C. | 样品中CuO的质量为4.0 g | D. | V=896 |
分析 硫酸足量,由氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,以此来解答.
解答 解:硫酸足量,由于氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,
A、Fe的物质的量为$\frac{3.2g}{160g/mol}$×2=0.04mol,其质量为:0.04mol×56g/mol=2.24g,故A正确;
B、生成的滤渣3.2g是铜,金属铜可以和三价铁反应,所以一定不含有+3价铁离子,则溶液A中含Fe2+、H+,故B错误;
C、根据B的答案知道铁元素质量=2.24g,而原来固体才5.76g,所以CuO质量不超过5.76-2.24=3.52g,故C错误;
D、最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量:$\frac{5.76g-3.2g-2.24g}{16g/mol}$=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气,即生成0.02mol氢气,标况体积为448mL,故D错误.
故选A.
点评 本题考查金属及化合物的性质、混合物分离提纯综合应用等,为高频考点,题目难度中等,把握物质的性质及氧化还原反应等为解答的关键,侧重分析与应用能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-1-丁烯与1-己炔 | |
| B. | 3-甲基-2-乙基-2-戊烯与3-乙基庚烯 | |
| C. | 2-甲基-1,3-丁二烯与2-戊炔 | |
| D. | 2-己炔与2,3-二甲基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
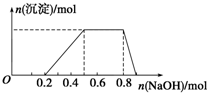 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,已知①该溶液的焰色反应没有黄色;②当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.由此可知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应的特征是正反应速率和逆反应速率相等 | |
| B. | 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 | |
| C. | 在其他条件不变时,升高温度可以使平衡向放热反应方向移动 | |
| D. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
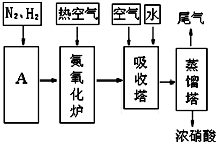
 CO+3H2.
CO+3H2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与水反应可生成酸的氧化物都是酸性氧化物 | |
| B. | 既能与酸反应又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| C. | 晶体的熔化、水的汽化和液化、KMnO4溶液的酸化以及煤的气化和液化均属物理变化 | |
| D. | 有单质参加的反应或有单质生成的反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸,沉淀不溶解,该溶液一定含有SO42- | |
| B. | 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色,该溶液一定含有Fe2+ | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,该溶液一定含有CO32- | |
| D. | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体,该溶液一定含有NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com