
 .
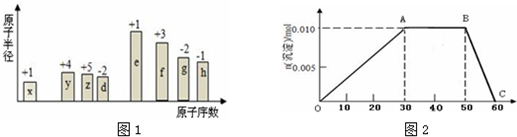
.分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)h为Cl元素,其原子核外有17个电子分三层排布;
(2)①R是(NH4) aAl b(SO4)c,根据Al3+、NH4+消耗的氢氧化钠计算ab,根据化合价的代数和为零计算c;
②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)h为Cl元素,其原子核外有17个电子分三层排布,其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)①R是(NH4) aAl b(SO4)c,滴加氢氧化钠发生反应Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3•H2O,根据消耗的氢氧化钠可知n(NH4+):n(Al3+)=2:1,当a=4,b=2时,由化合价的代数和为零可知,c=5,所以a:b:c=4:2:5,
故答案为:4:2:5;
②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为:NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O.
点评 本题考查结构位置性质关系、化学图象及化学计算,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等,注意把握图象中各段发生的反应.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 2,2-二甲基戊醇 | B. | 2,2-二甲基-4-戊醇 | ||
| C. | 1,3,3-三甲基丁醇 | D. | 4,4-二甲基-2-戊醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.76×10-5 | K1=4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 中和等体积、等pH的CH3COOH溶液和HCN溶液消耗NaOH的量前者大于后者 | |
| B. | 可发生反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ | |
| C. | Na+、CN-、CH3COO-、HCO3-等离子能大量共存 | |
| D. | 等浓度的CH3COONa和NaCN溶液pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 样品中Fe元素的质量为2.24 g | B. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | ||
| C. | 样品中CuO的质量为4.0 g | D. | V=896 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Fe(OH)3与HCl | D. | HNO3与KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Cl- | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中①组反应当n(FeBr2):n(Cl2)≥$\frac{1}{2}$一种元素被氧化、当n(FeBr2):n(Cl2)<$\frac{1}{2}$两种元素被氧化 | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com