
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
![]()
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________。
【答案】![]() ⅦA CH2=CH2 AlCl3+3H2O=Al(OH)3+3HCl↑ 2NH3·H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O a和c CS2(l)+3O2(g)=CO2(g)+2SO2(g) △H=-1075kJ/mol
ⅦA CH2=CH2 AlCl3+3H2O=Al(OH)3+3HCl↑ 2NH3·H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O a和c CS2(l)+3O2(g)=CO2(g)+2SO2(g) △H=-1075kJ/mol
【解析】
J元素最低负化合价的绝对值与其原子最外层电子数相等,则J为C元素;根据J、R在周期表中的相对位置可知R为S元素;则T为Cl元素;M是地壳中含量最多的金属元素,则M为Al元素;根据L的最简单气态氢化物甲的水溶液显碱性可L为N元素。
(1)M为Al,其离子结构示意图为![]() ;元素T为Cl,最外层有7个电子,在周期表中位于第ⅦA族。
;元素T为Cl,最外层有7个电子,在周期表中位于第ⅦA族。
(2)J为C,和氢组成的化合物分子有6个原子,则为乙烯,其结构简式为CH2=CH2。
(3)M和T形成的化合物AlCl3在潮湿的空气中冒白色烟雾,即AlCl3和空气在的水蒸气反应生成白色固体Al(OH)3,同时生成HCl,反应的化学方程式为AlCl3+3H2O=Al(OH)3+3HCl↑。
(4)①在微电子工业中,甲的水溶液即氨水可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,氨水中的-3价氮被H2O2氧化为N2,其化学方程式为2NH3·H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O。
②一定条件下,氨在固定体积的密闭容器中发生分解反应2NH3(g)![]() N2(g)+3H2(g)(△H>0)达平衡后,a.升高温度,平衡正向移动,氨的物质的量减小,正确;b.升高温度,平衡正向移动,平衡常数增大,错误;c.增加氢气的物质的量,平衡逆向移动,氨的转化率降低,正确;d.再加入氨,平衡正向移动,生成更多的生成物,错误;故选ac;
N2(g)+3H2(g)(△H>0)达平衡后,a.升高温度,平衡正向移动,氨的物质的量减小,正确;b.升高温度,平衡正向移动,平衡常数增大,错误;c.增加氢气的物质的量,平衡逆向移动,氨的转化率降低,正确;d.再加入氨,平衡正向移动,生成更多的生成物,错误;故选ac;
(5)由J、R形成的液态化合物CS2 0.2mol在O2中完全燃烧,生成两种气态氧化物,即CO2和SO2,298K时放出热量215kJ,则1mol CS2在氧气在完全燃烧,放出的热量为215kJ ×5=1075kJ的热量,故该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g) △H=-1075kJ/mol。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
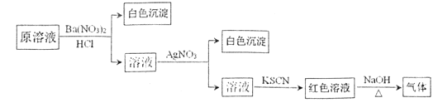
A.原溶液中一定含有![]() 离子B.原溶液中一定含有
离子B.原溶液中一定含有![]()
C.原溶液中一定含有Cl-离子D.原溶液中一定含有Fe3+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为3.92 L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A. 2.80 LB. 3.92 LC. 5.60 LD. 7.84 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )

A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )

A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
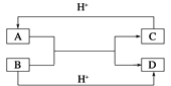
(1)如果A,B,C,D均是10电子的粒子,请写出A,D的电子式:A_______;D_______。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式为__________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于合成氨N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
A. 升高温度,对正反应的反应速率影响更大
B. 增大压强,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氨气制取尿素的反应为:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) ΔH<0
(1)该反应能自自发进行的条件是___________
(2)反应在恒容密闭容器中达到平衡时,下列说法不正确的是________
A.加入催化剂,平衡常数不变
B.容器内的压强不再变化
C.容器内的气体密度不再变化
D.降低温度,平衡向正反应方向移动
(3)某温度下,向容积为10L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%。
①该段时间内用NH3表示的平均反应速率为___________
②该温度下此反应平衡常数K的值为________。
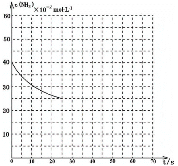
③图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若在25s时保持其它条件不变情况下使用催化剂,使反应延续至70s,请在图中用实线画出25~70s内该反应的进程曲线__________。
(4)尿素在水溶液中会分解,某研究小组分别用三份不同初始浓度的尿素溶液测定分解反应速率,得到c(CO(NH2)2)随时间变化趋势如图所示:
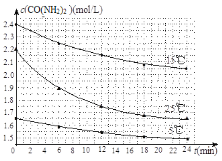
根据图中信息,如何说明分解反应速率随温度升高而增大__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为CO(NH2)2+H2O=3H2↑+N2↑+CO2↑。下列说法中错误的是
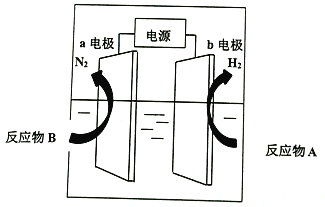
A. a为阳极,CO(NH2)2发生氧化反应
B. b电极反应为:2H2O+2e-=H2↑+2OH-
C. 每转移6mol电子,a电极产生1molN2
D. 电解一段时间,a极区溶液pH升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com