
已知N2+3H2![]() 2NH3,根据下图判断:
2NH3,根据下图判断:
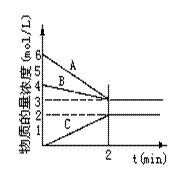 A是_____________的物质的量浓度变化情况。反应开始时,C(N2)=_____________ ;2min时C(NH3)=_____________________,
A是_____________的物质的量浓度变化情况。反应开始时,C(N2)=_____________ ;2min时C(NH3)=_____________________,
0-2min内氢气的平均反应速率v(H2)= ___________________。
(2)一定条件下,可逆反应A2+B2![]() 2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)=0.1mol/L C(C)= 1.6 mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)=0.1mol/L C(C)= 1.6 mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
①a、b应满足的关系是______________。
②a的取值范围是________,说明理由___________________________。
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
(12分)已知N2+3H22NH3,根据下图判断:
A是_____________的物质的量浓度变化情况。反应开始时,C(N2)=_____________ ;2min时C(NH3)=_____________________,
0-2min内氢气的平均反应速率v(H2)=___________________。
(2)一定条件下,可逆反应A2+B22C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)=0.1mol/L C(C)= 1.6 mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
①a、b应满足的关系是______________。
②a的取值范围是________,说明理由___________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年安徽省合肥一中高二下学期期中考试化学试卷 题型:填空题
(12分)已知N2+3H2 2NH3,根据下图判断:
2NH3,根据下图判断: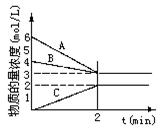
A是_____________的物质的量浓度变化情况。反应开始时,C(N2)="_____________" ;2min时C(NH3)=_____________________,
0-2min内氢气的平均反应速率v(H2)= ___________________。
(2)一定条件下,可逆反应A2+B2 2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)="0.1mol/L" C(C)=" 1.6" mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)="0.1mol/L" C(C)=" 1.6" mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
①a、b应满足的关系是______________。
②a的取值范围是________,说明理由___________________________。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省高二下学期期中考试化学试卷 题型:填空题
(12分)已知N2+3H2 2NH3,根据下图判断:
2NH3,根据下图判断:
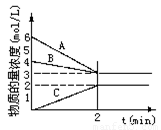
A是_____________的物质的量浓度变化情况。反应开始时,C(N2)=_____________ ;2min时C(NH3)=_____________________,
0-2min内氢气的平均反应速率v(H2)= ___________________。
(2)一定条件下,可逆反应A2+B2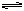 2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)=0.1mol/L C(C)= 1.6 mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
2C达到了化学平衡状态,经测得平衡时C(A2)= 0.5mol/L,C(B2)=0.1mol/L C(C)= 1.6 mol/L。若A2、B2、C的起始浓度分别以a mol/L、b mol/L、cmol/L表示,请回答:
①a、b应满足的关系是______________。
②a的取值范围是________,说明理由___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 N2+3H2![]() 2NH3 △H<0,若将此反应设计成燃料电池,盐酸为电解质溶液,下列说法错误的是( )
2NH3 △H<0,若将此反应设计成燃料电池,盐酸为电解质溶液,下列说法错误的是( )
A:燃料电池正极充入N2 B:电池的负极反应为H2-2e-=2H+
C:电池的正极反应为 N2+6e-+6H+==2NH3 D:电池工作时正极发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com