
2SO2(g)+O2(g) 2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ĸ����������Ϊ2 L�ĺ����ܱ�������Ͷ�ϣ�����ʼ���ʵ���������Ӧ���ƽ��ת�������±���ʾ��
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ĸ����������Ϊ2 L�ĺ����ܱ�������Ͷ�ϣ�����ʼ���ʵ���������Ӧ���ƽ��ת�������±���ʾ��
|
| �� | �� | �� | �� |
��ʼ���ʵ��� | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
����Ӧ���ƽ��ת����% | 80 |
|
|
| |
�����ж��У���ȷ����
A������SO3��ƽ��ת����Ϊ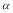 1=20% B��ƽ��ʱ������c(SO3)�Ǽ��е�2��
1=20% B��ƽ��ʱ������c(SO3)�Ǽ��е�2��
C��ƽ��ʱ��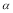 3<
3<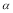 1 D�����¶��£�ƽ�ⳣ����ֵΪ400
1 D�����¶��£�ƽ�ⳣ����ֵΪ400
CD
��������
������������ڼף�����SO2��ת������80%������ƽ��ʱ�������ʵ����ʵ����ֱ��ǣ�n(SO2)=0.08mol��n(O2)=0.08mol��n(SO3)=0.32mol�������ڸ��¶��µĻ�ѧƽ�����K= ���¶Ȳ��䣬��ѧƽ�ⳣ���Ͳ��䡣A�����ڷ�Ӧ���ں��º��������½��еģ������൱�ڿ�ʼ����n(SO2)=0.4mol��n(O2)=0.2mol��n(SO3)=0 mol������������Ũ�ȱȼ�С������SO2��ת����С��80%����SO3��ת����
���¶Ȳ��䣬��ѧƽ�ⳣ���Ͳ��䡣A�����ڷ�Ӧ���ں��º��������½��еģ������൱�ڿ�ʼ����n(SO2)=0.4mol��n(O2)=0.2mol��n(SO3)=0 mol������������Ũ�ȱȼ�С������SO2��ת����С��80%����SO3��ת���� 1>20%,����B.���ڱ����ڿ�ʼ����Ķ�����������������ʵ����ǼĶ����������˷�Ӧ���Ũ�ȣ�ƽ�������ƶ���SO2��ת������������ƽ���ƶ������������ģ�����ƽ��ʱ����c(SO3)�ȼ��е�2��ҪС�Ķ࣬����C�����ڶ��п�ʼ����ĸ������ʵ����ʵ����ֱ��ǣ�n(SO2)=0.02mol��n(O2)=0.04mol��n(SO3)=0.4 mol�����Ե�Чת������ΪSO3�Ƿ�Ӧ�����ģ������Ч��ʼ״̬��n(SO2)=0.42mol��n(O2)=0.24mol��n(SO3)=0 mol��������Ũ�Ȳ��䣬��������SO2��Ũ�ȡ�����Ӧ���Ũ�ȣ��ܹ�ʹ������Ӧ���ת������ߣ����䱾����ת���ʷ������ͣ�����ƽ��ʱ��
1>20%,����B.���ڱ����ڿ�ʼ����Ķ�����������������ʵ����ǼĶ����������˷�Ӧ���Ũ�ȣ�ƽ�������ƶ���SO2��ת������������ƽ���ƶ������������ģ�����ƽ��ʱ����c(SO3)�ȼ��е�2��ҪС�Ķ࣬����C�����ڶ��п�ʼ����ĸ������ʵ����ʵ����ֱ��ǣ�n(SO2)=0.02mol��n(O2)=0.04mol��n(SO3)=0.4 mol�����Ե�Чת������ΪSO3�Ƿ�Ӧ�����ģ������Ч��ʼ״̬��n(SO2)=0.42mol��n(O2)=0.24mol��n(SO3)=0 mol��������Ũ�Ȳ��䣬��������SO2��Ũ�ȡ�����Ӧ���Ũ�ȣ��ܹ�ʹ������Ӧ���ת������ߣ����䱾����ת���ʷ������ͣ�����ƽ��ʱ�� 3<
3< 1����ȷ��D������ѡ��A�ļ����֪���¶��£�ƽ�ⳣ����ֵΪ400����ȷ��
1����ȷ��D������ѡ��A�ļ����֪���¶��£�ƽ�ⳣ����ֵΪ400����ȷ��
���㣺�������ʵ���Ũ�ȶԻ�ѧƽ���ƶ���Ӱ�졢��Чƽ�⡢���ʵ�ת���ʵıȽϺ�ƽ������ļ��㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����ظ߶���ѧ�����е��в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ���ѧ�����������ͻ���������ء������й�˵���д������
A���ԷϾɵ�ؽ��л��մ�������Ҫ��Ϊ�˻��������ͱ��Ϊ��
B���õ��ˮ�ķ�����ȡ����H2�����Ի�����Դ���������
C������������Ӧ������Դ������ʵ�֡���̼���á�
D����ҵ�ϣ����ܲ��õ��MgCl2��Һ�ķ�����ȡ����þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�߶���ѧ��4�½β��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
H2Sˮ��Һ�д��ڵ���ƽ��H2S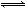 H++HS-��HS-
H++HS-��HS-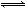 H++S2-������H2S��Һ��
H++S2-������H2S��Һ��
A���μ�������ˮ,��ҺpH��С B��ͨ�����SO2����,��ҺpH����
C����ˮ,��Һ��������Ũ������ D��������������ͭ����,��������Ũ�ȶ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������ѧ�������Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����٤��������ֵ������������ȷ����
A��78gNa2O2�����к��е���������ΪNA
B����״���£�2.24L��������ԭ����Ϊ0.2NA
C��1L 0.1 mol/L������Һ�к��е���������Ϊ0.1NA
D����״���£�2.24L���麬�з��ӵ���ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ������
��14�֣��ۺ��Ȼ�����һ�����;�ˮ��������������Ũ�ȣ���AlT��ʾ�������������ҪΪAl3+�ĵ�����̬����Ũ�ȣ���Ala��ʾ������ҪΪ[AlO4Al12(OH)24(H2O)12]7+���еȾۺ���̬����Ũ�ȣ���Alb��ʾ����Al(OH)3������̬����Ũ�ȣ���A1c��ʾ����
��1��һ�������£���1.0 mol/LAlCl3��Һ�м���0.6 mol/L��NaOH��Һ�����Ƶ�Alb����ԼΪ86���ľۺ��Ȼ�����Һ��д������[AlO4Al12(OH)24(H2O)12]7+�����ӷ���ʽ��_____________________��
��2����Ĥ�����MD��Ũ���������ۺ��Ȼ�����Һ����Ũ����ʵ������в�ͬŨ�Ⱦۺ��Ȼ���������̬�ֲ����ٷ��������±���
AlT/��mol��L��1�� | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
����һ���¶��£�AlTԽ��pH���Խ����ԽС�����䡱����
���罫AlT = 2.520 mol��L��1�ľۺ��Ȼ�����Һ��ˮϡ�ͣ���ϡ��������Ҫ������Ӧ�����ӷ���ʽ�� ��
��Ĥ������Һ�¶ȶ����ۺ���̬�ٷ�����������Ũ�ȵ�Ӱ����ͼ20��1����T>80��ʱ��AlT�����½���ԭ���� ��
��3�����̼�Ȼ�ԭһ��������ʵ�����������Ʊ�����������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g)��H1 = a kJ��mol��1
��3AlCl(g) = 2Al(l)+ AlCl3(g)��H2 = b kJ��mol��1
��ӦAl2O3(s)+ 3C(s) = 2Al(l)+ +3CO(g)��H = kJ��mol��1���ú�a��b�Ĵ���ʽ��ʾ������Ӧ�ٳ�ѹ����1900��ĸ����²��ܽ��У�˵����H 0���>����=����<������
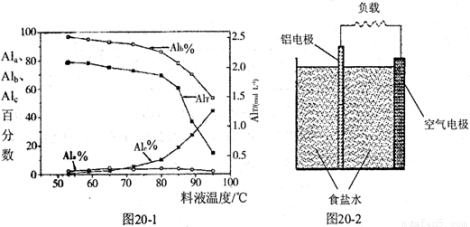
��4��һ����������ؽṹ��ͼ20��2��ʾ��д���õ�������ĵ缫��Ӧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��Q��W��X��Y��Z��ԭ��������������XԪ�ص���ɫ��Ӧ�ʻ�ɫ��Qԭ�ӵ����������������ڲ��������2����W��Zԭ�ӵ�������������ͬ��ZԪ�صĺ˵������W��2����Y�ǵؿ��к������Ľ���Ԫ�ء�����˵������ȷ���� �� ��
A����ҵ�ϳ��õ��ķ����Ʊ�X��Y�ĵ���
B��Ԫ��Q��Z���γ�QZ2�͵Ĺ��ۻ�����
C��ԭ�Ӱ뾶�Ĵ�С˳��r(X)> r(Y)> r(W)> r(Q)
D��Ԫ��X��Y������������Ӧ��ˮ����֮���ܷ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����и���������ָ����Һ��һ���ܴ���������ǣ���
A��1.0 mol��L��1KNO3��Һ��H+��Fe2+��SCN����SO42��
B��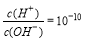 ����Һ��K+��Ba2+��NO3����Cl��
����Һ��K+��Ba2+��NO3����Cl��
C��pH=0����Һ��Al3+��Cl����SO42����CO32��
D��c(ClO��) = 1.0 mol��L��1����Һ��Na+��I����S2����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015����������и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��λ�����ϡ��Һ�У��ǻӷ������ʵķ��ӻ�������Խ�࣬����Һ�ķе��Խ�ߡ���������Һ�е���ߵ���
A��0.01 mol��L��1��������Һ B��0.01 mol��L��1��CaCl2��Һ
C��0.02 mol��L��1��NaCl��Һ D��0.02 mol��L��1��CH3COOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡտ���и���8���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ��� ����
A�������ǵ���ʡ�Һ���Ƿǵ����
B��������Һ�����ᡢ�Ȼ�����Һ��Ϊ����
C�����ۡ���ά�ء���֬��������Ȼ�߷��ӻ�����
D��SO3��SiO2��NO2������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com