
H2S水溶液中存在电离平衡H2S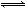 H++HS-和HS-
H++HS-和HS-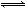 H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
A.滴加新制氯水,溶液pH减小 B.通入过量SO2气体,溶液pH增大
C.加水,溶液中氢离子浓度增大 D.加入少量硫酸铜固体,所有离子浓度都减小
A
【解析】
试题分析:A. 若向H2S溶液中滴加新制氯水,,发生反应:H2S+ Cl2== 2Cl-+2H++S↓。c(H+)增大,所以溶液pH减小。正确。B. 若向H2S溶液中滴加通入过量SO2气体, 发生反应:2H2S+ SO2 =3S↓+2H2O, SO2+H2O =H2SO3。H2SO3是中强酸,H2SO3比H2S更容易电离产生H+。所以溶液pH减小。错误。C.加水电离平衡正向移动,都是稀释作用大于平衡正向移动使离子浓度增大的趋势,溶液中氢离子浓度反而减小。错误。D.加入少量硫酸铜固体,发生反应:S2-+Cu2+=CuS↓。电离平衡H2S H++HS-和HS-
H++HS-和HS-  H++S2-正向移动,c(H+)增大。错误。
H++S2-正向移动,c(H+)增大。错误。
考点:考查各种外加条件对弱电解质电离平衡的影响的知识。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列有关说法不正确的是
2CO32-+6H2O,则下列有关说法不正确的是
A、放电时化学能转变为电能 B、放电时CH3OH参与正极反应
C、充电时阴极产生CH3OH D、充电时每生成1mol CH3OH,则转移6mol电子
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.6 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.15mol·L-1·s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.3 mol·L-1
其中正确的是
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
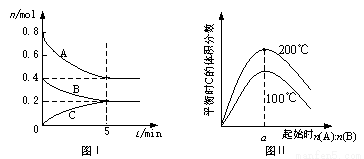
A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 02 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g) zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.NH3·H2O NH4++OH-达到平衡后,升高温度平衡正向移动
NH4++OH-达到平衡后,升高温度平衡正向移动
B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率
C.明矾水解生成Al(OH)3胶体,可用作净水剂
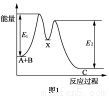
D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
(12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石
(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是
可燃性气体,则其反应的化学方程式为 。 该可燃气体在酸性
条件下,可制成燃料电池,写出该气体发生的电极反应式 。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe203)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
① 原电池反应:
负极:2Fe-4e-=2Fe2+、正极: ;
② 氢氧化物的形成: Fe2 + + 2OH-= Fe(OH) 2↓ 。
③ 氢氧化物的分【解析】
2Fe(OH)3 =Fe2O3+3H2O。
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为 (填“正极”或“负极”),
铁制品表面发生的电极反应式 为 。
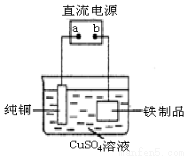
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能发生,则该反应的△H>0
B.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中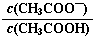 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
2SO2(g)+O2(g) 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
|
| 甲 | 乙 | 丙 | 丁 |
起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
含硫反应物的平衡转化率% | 80 |
|
|
| |
下列判断中,正确的是
A.乙中SO3的平衡转化率为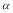 1=20% B.平衡时,丙中c(SO3)是甲中的2倍
1=20% B.平衡时,丙中c(SO3)是甲中的2倍
C.平衡时,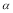 3<
3<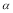 1 D.该温度下,平衡常数的值为400
1 D.该温度下,平衡常数的值为400
查看答案和解析>>
科目:高中化学 来源:2015届广东肇庆中学高三8月考理综化学试卷(解析版) 题型:选择题
下述实验不能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 将铜片分别与浓、稀硝酸反应 | 探究浓、稀硝酸氧化性的相对强弱 |
B | 将Cl2通入NaBr溶液中,然后加入CCl4,振荡、静置 | 比较氯与溴的氧化性强弱 |
C | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有漂白性 |
D | 向盛有20 g蔗糖的烧杯中加入几滴水,搅拌均匀。再加入少许浓硫酸,迅速搅拌 | 探究浓硫酸的脱水性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com