
【题目】某铁的氧化物,用7.0 mol/L的盐酸100 mL在一定条件下恰好完全溶解,所得溶液中再通入0.56L标况下的Cl2时,刚好使溶液中的Fe2+全部转化为Fe3+,则该氧化物中Fe2+与Fe3+的物质的量之比为
A.1:4B.2:1C.4:1D.3:4
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】主族元素X、Y、Z、W的原子序数依次增加,且均不大于20,X的单质是手机电池重要的电极材料;常温下,Y的两种气态氧化物之间可发生可逆反应;X、Y、W最外层电子数之和与Z的最外层电子数相等;W能形成多种氧化物。下列说法正确的是
A.常温下,Z的单质与Y的简单氢化物相遇,可能产生白烟
B.Z非金属性强于Y,其对应含氧酸的酸性:Z>Y
C.原子半径:X>Y;简单离子半径:Z<W
D.X、W的单质均为活泼金属,通常保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是( )
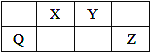
A. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Y的原子半径比X的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种溶液分别含有下列十种离子中的各不相同的五种:H+、Al3+、Na+、Cu2+、![]() 、OH-、
、OH-、![]() 、
、![]() 、
、![]() 、Cl-。下列判断正确的是( )
、Cl-。下列判断正确的是( )
A.若A溶液为无色溶液,则A溶液中可能含有:H+、Al3+、Cl-、![]() 、
、![]()
B.若A溶液有强还原性,则B溶液中可能含有:H+、Cu2+、Al3+、Cl-、![]()
C.若B溶液呈强碱性,则A溶液中可能含有:H+、Al3+、Na+、Cu2+、![]()
D.若B溶液有强氧化性且各离子浓度相同,则B溶液可能含有:H+、Al3+、Cu2+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:

下列叙述错误的是
A. “含Mn2+、A13+的溶液”中还含Fe3+
B. 加入“氨水”同时搅拌,搅拌的目的是提高反应速率
C. “滤渣”可完全溶解在NaOH溶液中
D. 电解含Mn2+的溶液,MnO2为阳极产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗禽流感药物达菲可用莽草酸为原料来合成。莽草酸结构简式如图所示。下列说法正确的是

A.莽草酸的化学式为C7H6O5
B.1mol莽草酸最多能和4molNaOH发生反应
C.莽草酸分子中所有碳原子共平面
D.莽草酸在一定条件下可以发生取代、加成、消去、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示。下列有关芥子醇的说法正确的是( )
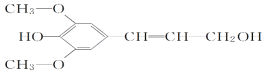
A. 芥子醇的分子式是C11H14O4,属于芳香烃
B. 1 mol芥子醇与足量浓溴水反应,最多消耗3 mol Br2
C. 芥子醇不能与FeCl3溶液发生显色反应
D. 芥子醇能发生的反应类型有氧化反应、取代反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为 ______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液 ______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

①亚磷酸属于 ______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)= ______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为 ______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:
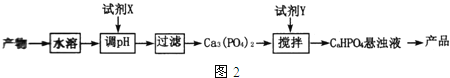
①试剂X为 ______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH ______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,M为金属活动性顺序表中位于氢之前的金属,N为石墨棒,下列关于此装置的叙述中不正确的是

A.N上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com