
【题目】下列离子方程式书写不正确的是
A.FeCl2溶液中通入Cl2:![]()
B.Ba(OH)2溶液与盐酸的反应:![]()
C.Al(OH)3沉淀中滴加盐酸:![]()
D.AlCl3溶液中加入过量氨水:![]()
科目:高中化学 来源: 题型:
【题目】多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处。Na2Sx在碱性溶液中与NaClO反应可生成Na2SO4,下列说法错误的是
A.NaClO是氧化剂
B.Na2SO4是氧化产物
C.若反应中Na2Sx与NaClO的物质的量之比为1:13,则x为5
D.若x=3,则反应的离子方程式为:S32-+10ClO-+4OH-=3SO42-+10Cl-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洋蓟属高档蔬菜。从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为( )

A.A在酸性条件下水解生成B和C属于取代反应
B.1molA和足量H2反应,最多消耗14molH2
C.B能和浓溴水发生加成反应,1molB最多加成4molBr2
D.1molC分子最多可以和5molNaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)《本草纲目》曾记载利尿剂甘汞(Hg2Cl2)制法:“用水银一两,白矾[KAl(SO4)212H2O]二两,食盐一两,同研,不见星。铺于器内,以小乌盆覆之,筛灶灰,盐水和,封固盘口,以炭打二柱香取开,则粉升于盆上矣,其白如雪,轻盈可爱,一两汞可升粉八钱。”
①KAl(SO4)212H2O所属物质类别为___________ (填标号)。
A.硫酸盐 B.酸式盐 C.正盐 D.电解质
②文中“则粉升于盆上矣”涉及的分离方法是___________。
③甘汞(Hg2Cl2)制备反应中,还原剂与氧化剂的物质的量之比为_______,该反应中还原产物是_______。
④由甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),该反应化学方程式为_________。
(2)H2O2、酸性KMnO4在生产、生活、医疗卫生中常用作消毒剂,高锰酸钾造成的污渍可用草酸 (H2C2O4 )去除,完成下列问题。
①对于下列涉及H2O2的反应,H2O2仅体现氧化性的反应是_____(填标号,下同),H2O2既体现氧化性又体现还原性的反应是_______。
A.Ag2O+H2O2=2Ag+O2↑+H2O
B.2H2O2=2H2O+O2↑
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
②酸性高锰酸钾与草酸反应,氧化产物与还原产物的物质的量之比为___________。
③在稀硫酸中,KMnO4和H2O2反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息。
硫酸亚铁片 英文名:Ferrous Sulfate Tablets 本品含硫酸亚铁(FeSO4·7H2O)应为标示量的95.0%~110.0% | 氢氧化铝片 英文名:Aluminium Hydroxide Tablets |
(主要成分)糖衣、碳酸镁、氢氧化铝、淀粉 | |
(性状)本品为糖衣,除去糖衣后显淡绿色 | (适应症)能缓解胃酸过多 |
(鉴别)取本品,除去糖衣,称取适量(约相当于硫酸亚铁片0.2g),加稀盐酸1滴与水20mL,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应 | (用法用量)成人:口服,一次0.6~0.9g(一次2~3片),一日3次,餐前1小时服用 |
(详细用法)详见说明书 |
I、根据“硫酸亚铁片”标签回答问题:
(1)硫酸亚铁片溶于水后溶液的颜色是_______________。
(2)硫酸盐中检验![]() 的离子反应方程式是______________________________________。
的离子反应方程式是______________________________________。
(3)鉴别中,“加稀盐酸1滴”的作用是__________________________________________。
(4)检验硫酸亚铁片是否被氧化的方法是________________________________________。
II、根据“氢氧化铝片”标签回答问题:
(1)能缓解胃酸过多的成分是__________________________________________。
(2)氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的______________。
A. 酸性 B. 碱性 C. 两性 D. 氧化性
(3)写出氢氧化铝的电离方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物H是一种治疗心血管疾病药物的中间体。一种合成H的路线:
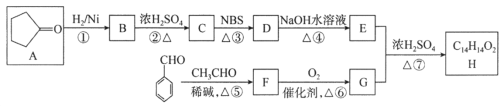
已知:信息① CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
信息② ![]()
回答下列问题:
(1)C的化学名称为________________,D中的官能团名称是__________________。
(2)②的反应类型是______________________________________。
(3)F的结构简式为______________________________________。
(4)写出由E和G生成H的化学方程式:__________________________________________。
(5)芳香族化合物Q是H的同分异构体,一定条件下,H和Q分别与足量H2加成,得到同一种产物,则Q的可能结构有________种(环中没有碳碳叁键,也没有连续的碳碳双键,不考虑立体结构),其中分子内存在碳碳叁键的同分异构体的结构简式为______________。
(6)呋喃丙烯酸(![]() )是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以
)是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以![]() 为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、铁、铝是应用最广泛的三种金属。
(1)它们在人类的金属使用历史中,由早到晚的顺序为__________________________。
(2)日常常用“铝壶”烧开水,是因为铝有良好的导热性、__________________________。
(3)野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。写出反应的化学方程式________________________________________________,该反应是_______ (填:吸或放)热反应,其中铝发生________(填:氧化或还原)反应。
(4)表面破损的铝制品,放久了破损处会有一层“白毛”产生,“白毛”既能溶于酸又能溶于碱溶液,写出形成“白毛”的化学方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com