
【题目】洋蓟属高档蔬菜。从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为( )

A.A在酸性条件下水解生成B和C属于取代反应
B.1molA和足量H2反应,最多消耗14molH2
C.B能和浓溴水发生加成反应,1molB最多加成4molBr2
D.1molC分子最多可以和5molNaOH溶液反应
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g);△H>0
CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___。
(2)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,维持其他条件不变,若打开K,一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响)。
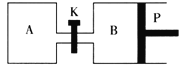
Ⅱ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)![]() CH3OH(g)
CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.27 | 0.012 |
(1)300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,判断反应___(填“正向”或“逆向”)进行。
(2)要提高CO的转化率,可以采取的措施是___(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在实验室研究Al与CuCl2溶液的反应.
实验操作 | 实验现象 |
|
|
(1)现象![]() 中的红色物质是 ______ .
中的红色物质是 ______ .
(2)经检验现象![]() 中的无色气体为氢气.
中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因 ______.
②氢气从红色物质表面逸出的原因是 ______ .
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液![]()
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是 ______.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因 ______.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有 ______性.
②取Cu粉与1mol/LCuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):乙烯![]() A
A![]() 乙醇
乙醇![]() 乙醛
乙醛![]() 乙酸。按下列要求写出:
乙酸。按下列要求写出:
(1)乙醇中含氧官能团名称为________,乙酸中含氧官能团名称为________
(2)写出下列反应方程式:
反应:____________
反应④:____________
(3)反应④的实验现象为:___________。实验室常用银氨溶液检验乙醛,所需用的实试剂2%硝酸银溶液和2%稀氨水;银氨溶液配制的方法是:______
(4)反应为乙醇与氧气在加热及Cu催化条件下反应生成乙醛,依次写出反应中铜丝由红变黑,再由黑变红过程中的化学方程式:__________、_______。
(5)若用如图所示装置试管a中收集乙醇催化氧化的产物:
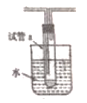
①水浴的作用为_______________,用姿色石蕊试纸检验收集的产物,试纸显红色,说明液体中还含有__________。
②要除去该物质,可在混合液中加入______(填写字母)
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等。
Ⅰ.亚氯酸钠的制备
以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
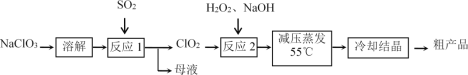
(1)“反应1”中的氧化剂是_____(填化学式,下同),母液中溶质的主要成分是_____。
(2)每有1mol SO2参加反应,理论上可生成ClO2的物质的量为________mol。
(3)如果将SO2换为Na2SO3和稀H2SO4,则“反应1”的离子方程式为________。
(4)“反应2”使用H2O2而不使用其他物质的主要理由是____________________。
Ⅱ.亚氯酸钠的应用
(5)用亚氯酸钠作水处理剂,水中可能残留少量亚氯酸钠,可以加入硫酸亚铁除去残留的亚氯酸盐,硫酸亚铁除可与亚氯酸钠反应外,还可以起到的作用是____________。
(6)实验室可用亚氯酸钠和氯酸钠在酸性条件下反应制备ClO2气体。
①上述反应的离子方程式为____________。
②ClO2也可用于杀菌消毒,其消毒能力是等物质的量Cl2的_______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.FeCl2溶液中通入Cl2:![]()
B.Ba(OH)2溶液与盐酸的反应:![]()
C.Al(OH)3沉淀中滴加盐酸:![]()
D.AlCl3溶液中加入过量氨水:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。请按要求填空:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
1 | ||||||||
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表列①~⑨号元素中,原子半径最大的是________(填数字序号);非金属性最强的元素是________(填数字序号);最高价氧化物对应的水化物中酸性最强的是_______(填数字序号);化学性质最稳定的是________(填数字序号)。
(2)元素③的常见氢化物的电式为_________,此氢化物与元素⑨的氢化物化合后溶于水,水溶液中离子浓度由大到小的顺序是________(用离子符号表示)。
(3)将元素⑦的单质用砂纸打磨后,滴上几滴![]() 溶液片刻后表面会形成白色毛状物,该毛状物的化学式是______________。将元素⑦的单质的粉末与铁红混合在高温下反应会放出大量热,写出该反应的化学方程式____________
溶液片刻后表面会形成白色毛状物,该毛状物的化学式是______________。将元素⑦的单质的粉末与铁红混合在高温下反应会放出大量热,写出该反应的化学方程式____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com