
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):乙烯![]() A
A![]() 乙醇
乙醇![]() 乙醛
乙醛![]() 乙酸。按下列要求写出:
乙酸。按下列要求写出:
(1)乙醇中含氧官能团名称为________,乙酸中含氧官能团名称为________
(2)写出下列反应方程式:
反应:____________
反应④:____________
(3)反应④的实验现象为:___________。实验室常用银氨溶液检验乙醛,所需用的实试剂2%硝酸银溶液和2%稀氨水;银氨溶液配制的方法是:______
(4)反应为乙醇与氧气在加热及Cu催化条件下反应生成乙醛,依次写出反应中铜丝由红变黑,再由黑变红过程中的化学方程式:__________、_______。
(5)若用如图所示装置试管a中收集乙醇催化氧化的产物:
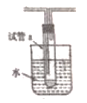
①水浴的作用为_______________,用姿色石蕊试纸检验收集的产物,试纸显红色,说明液体中还含有__________。
②要除去该物质,可在混合液中加入______(填写字母)
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________(填实验操作名称)即可除去。
【答案】羟基 羧基 CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl CH3CHO+2Cu(OH)2
CH3CH2OH+NaCl CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O 原来蓝色的氢氧化铜悬浊液转化为砖红色的氧化亚铜沉淀 在洁净的试管里加入1 mL 2%的硝酸银溶液,然后,一边摇动试管,一边逐滴滴加2%的稀氨水,直到最初产生的沉淀恰好溶解为止,制得银氨溶液 2Cu + O2
CH3COOH+Cu2O↓+2H2O 原来蓝色的氢氧化铜悬浊液转化为砖红色的氧化亚铜沉淀 在洁净的试管里加入1 mL 2%的硝酸银溶液,然后,一边摇动试管,一边逐滴滴加2%的稀氨水,直到最初产生的沉淀恰好溶解为止,制得银氨溶液 2Cu + O2 ![]() 2CuO CH3CH2OH+CuO
2CuO CH3CH2OH+CuO![]() CH3CHO+Cu+H2O 加热乙醇,便于乙醇的挥发 乙酸 c 蒸馏
CH3CHO+Cu+H2O 加热乙醇,便于乙醇的挥发 乙酸 c 蒸馏
【解析】
乙烯与HCl发生加成反应生成CH3CH2Cl,一氯乙烷在氢氧化钠水溶液加热的条件下发生取代反应生成乙醇,乙醇被催化氧化生成乙醛,乙醛再与新制氢氧化铜悬浊液反应得到乙酸。
(1)乙醇中含氧官能团为羟基,乙酸中含氧官能团为羧基;
(2)反应为一氯乙烷的取代反应,方程式为:CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl;
CH3CH2OH+NaCl;
反应④为醛基的氧化反应,方程式为:CH3CHO+2Cu(OH)2![]() CH3COOH+Cu2O↓+2H2O;
CH3COOH+Cu2O↓+2H2O;
(3)反应中可以观察到原来蓝色的氢氧化铜悬浊液转化为砖红色的氧化亚铜沉淀;银氨溶液的配制方法为:在洁净的试管里加入1 mL 2%的硝酸银溶液,然后一边摇动试管,一边逐滴滴加2%的稀氨水,直到最初产生的沉淀恰好溶解为止,制得银氨溶液;
(4)反应中铜丝由红变黑,再由黑变红过程中的化学方程式为:2Cu + O2 ![]() 2CuO、CH3CH2OH+CuO
2CuO、CH3CH2OH+CuO![]() CH3CHO+Cu+H2O;
CH3CHO+Cu+H2O;
(5)①水浴使温度升高,加热乙醇,便于乙醇的挥发;紫色石蕊试纸变蓝说明收集到的产物为酸性物质,结合反应物可知其为乙酸;
②乙酸为一种弱酸可以和碳酸氢钠发生反应,且碳酸氢钠不与乙醛反应,可用碳酸氢钠溶液与乙酸反应生成乙酸钠,之后通过蒸馏除去,所以选c。


科目:高中化学 来源: 题型:
【题目】如图是甲、乙、丙三种不同物质(不含结晶水)的溶解度曲线图。下列有关叙述正确的是( )
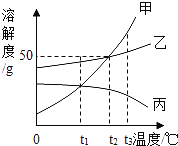
A.t1℃时,分别取出相同质量的甲、乙两种饱和溶液升温到t2℃时,甲和乙溶质的质量分数相等
B.将三种饱和溶液分别从t3℃降低到t2℃时,甲和乙溶质的质量分数减小,丙的溶质的质量分数不变
C.t2℃时,将甲、乙两种饱和溶液分别恒温蒸发等质量的水,析出晶体的质量可能不等
D.当甲的饱和溶液中含有少量乙时,可以采取冷却热饱和溶液的办法提取乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准氢氧化钠溶液(浓度为0.2812mol/L)测定未知浓度的盐酸溶液。
(1)写出化学方程式:____________
(2)滴定时可用_________作指示剂,当溶液由___色变成___色,且0.5min不褪时达到滴定终点。
(3)取20.00mL待测盐酸溶液,滴定终点时,消耗标准氢氧化钠30.00mL,待测盐酸溶液的浓度为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸厂的烟气中含有大量的氮氧化物(NO2),将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3[Ce中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是
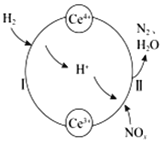
A.过程Ⅰ发生反应的离子方程式:H2+Ce4+═2H++Ce3+
B.x=l时,过程Ⅱ中氧化剂与还原剂的物质的量之比为2:1
C.处理过程中,混合溶液中Ce3+和Ce4+总数减少
D.该转化过程的实质为NOx被H2还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
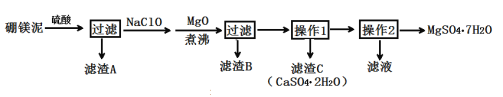
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洋蓟属高档蔬菜。从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为( )

A.A在酸性条件下水解生成B和C属于取代反应
B.1molA和足量H2反应,最多消耗14molH2
C.B能和浓溴水发生加成反应,1molB最多加成4molBr2
D.1molC分子最多可以和5molNaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
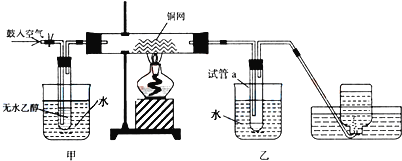
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:___,__。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化应是__反应。
(3)甲和乙两个水浴作用不相同。甲的作用是__;乙的作用是__。
(4)反应进行一段时间后,试管a中能收集到不同的物质,它们是__。集气瓶中收集到的气体的主要成分是___。(写名称)
(5)若试管a中收集到的液用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__。除去该物质,可先在混合液中加入___(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过___(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
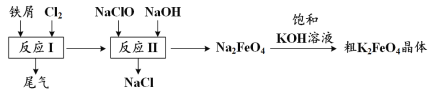
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com