
【题目】已知:pBa=-lgc(Ba2+),pKa=-lgc(Ka)。已知常温下H2CO3:pKa1=6.4,pKa2=10.3。向20mL 0.1mol·L1 BaCl2溶液中滴加0.2mol·L1 Na2CO3溶液的滴定曲线如图所示。下列说法正确的是

A. E、F、G三点的Ksp从大到小的顺序为:G>F>E
B. 其他条件相同,用MgCl2溶液替代BaCl2溶液,F点向G点迁移
C. 常温下,Ksp(BaCO3)≈1.0×109
D. 常温下,Na2CO3溶液的pKh1=7.6
【答案】C
【解析】
A.Ksp只与温度有关,所以E、F、G三点的Ksp应该相等,A项错误;
B.由于MgCl2和BaCl2均与等物质的量Na2CO3反应,用相同浓度MgCl2溶液替代BaCl2溶液,恰好完全反应时消耗的Na2CO3溶液的体积相同,但由于Ksp(BaCO3)<Ksp(MgCO3),所以pMg<pBa,故点应该在F的正下方,B项错误;
C.F点表示氯化钡溶液和碳酸钠溶液恰好完全反应生成碳酸钡和氯化钠,c(Ba2+)=c(CO32-),Ksp(BaCO3)≈1.0×109,C项正确;
D.CO32-+H2O![]() HCO3-+OH,pKh1=-lg(Kw/Ka2)=3.7,D项错误。
HCO3-+OH,pKh1=-lg(Kw/Ka2)=3.7,D项错误。
本题答案选C。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】浓度均为1 mol/L KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3︰2︰1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
A. 9︰6︰2 B. 9︰3︰1 C. 6︰3︰2 D. 6︰3︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法不正确的是
A.金属Na保存于水中B.浓硫酸保存于玻璃瓶中
C.HF溶液保存于塑料瓶中D.稀NaOH溶液保存于带胶塞的玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
① 18g D2O含有的电子数为10NA;
② 1mol Na2O2与水完全反应时转移电子数为2NA ;
③ 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA;
④ 在标准状况下,22.4LSO3的物质的量为1mol;
⑤ 7.8g过氧化钠中含有的离子数为0.3NA;
⑥ 28g 硅晶体中含有2NA个Si—Si键
⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
⑧ 在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA
⑨ 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
⑩ S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
A、①③⑤⑧ B、②④⑥⑦ C、③⑤⑥⑩ D、⑤⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
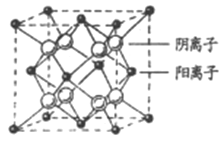
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学----选修5:有机化学基础)
![]() 是药物合成中的一种重要中间体,下面是
是药物合成中的一种重要中间体,下面是![]() 的一种合成路线:
的一种合成路线:

已知: 。
。
请回答下列问题:
(1)![]() 所含官能团的名称为___________;
所含官能团的名称为___________;![]() 的结构简式为_______________,
的结构简式为_______________,![]() 生成
生成![]() 的反应类型为_______________________。
的反应类型为_______________________。
(2)![]() 的名称是____________。
的名称是____________。
(3)由![]() 和
和![]() 合成
合成![]() 的化学方程式为______________________。
的化学方程式为______________________。
(4)![]() 的同分异构体中,能发生银镜反应且分子结构中含苯环的还有_______________种,其中核磁共振氢谱上有6组峰,峰面积之比为1:1:1:1:1:1的同分异构体的结构简式为__________(一种即可)。
的同分异构体中,能发生银镜反应且分子结构中含苯环的还有_______________种,其中核磁共振氢谱上有6组峰,峰面积之比为1:1:1:1:1:1的同分异构体的结构简式为__________(一种即可)。
(5)参照上述合成路线,以![]() 为原料(其他试剂任选),设计制备巴豆醛(
为原料(其他试剂任选),设计制备巴豆醛(![]() )的合成路线。________________________________________
)的合成路线。________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A. 密闭容器中混合气体的密度不变
B. 2v(NH3)正=v(CO2)逆
C. 密闭容器中c(NH3)∶c(CO2)=2∶1
D. 密闭容器中c(NH3)和c(CO2)浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com