
在如图所示两个装置中,溶液体积均为200mL,开始时电解质溶液浓度均为0.11mol/L,工作一段时间后,测得导线上通过0.02mol电子,若不考虑盐类的水解和溶液体积的变化,试求:
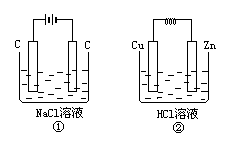
(1)两装置产生的气体在标准状况下所占体积各为多少升?
(2)两装置中反应后的pH各为多少?
|
(1)①中气体总体积为0.448L,②中气体体积为0.224L;(2)①中pH为13,②中pH为2 【巧解导析】装置①为电解池,用惰性电极电解NaCl溶液,类似氯碱工业,其电解方程式为:2NaCl+2H2O 装置②为原电池,其电池反应为Zn+2H+=Zn2++H2~2e-,电路中通过0.02mol电子时,消耗H+ 0.02mol,则反应后溶液中H+浓度为0.11- |
|
【巧解点悟】解题关键点:能准确书写电解反应方程式和电池反应方程式,找出已知量与未知量之间关系列式求解.易错点:不能找出H+浓度(或OH-)同电路中通过的电子之间的关系,将pH算错. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯气滴入品红溶液中 | 溶液褪色 | 氯气与水反应的产物有漂白粉 |
| Ⅱ | 向氯气中加入碳酸氢钠粉末 | 产生气泡 | 氯气与水反应的产物具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
(1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com