
I.高炉炼铁的主要反应为Fe2O3+3CO2Fe+3CO2。
已知该反应的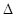 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
(1)该时间范围内的平均反应速率v(CO2)=_________mol/L min
min
(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
| A.减少Fe的量 | B.增加Fe2O3的量 |
| C.升高反应温度 | D.移出部分CO2 |
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
在T℃时,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)  aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
请回答下列问题:
(1)化学计量数a的值为________。
(2)下列能说明该反应达到了化学平衡状态的是________(填序号)。
a.容器内压强一定
b.容器内气体的密度一定
c.容器内Z的分子数一定
d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2 mol X、1 mol Y和1 mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是________kJ。
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2 mol X和1 mol Y,发生题给反应并达到平衡,则________(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M________N(填“>”、“<”或“=”)。
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
反应m A+n B p C在某温度下达到平衡
p C在某温度下达到平衡
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 。②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为______态。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
| 温度/℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 原料转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),
2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是 (填写名称)
该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是
| A.3V正(H2)=2V逆(NH3) | B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 | D.容器中气体的分子总数不随时间而变化 |
| | A | B | C | D |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
多晶硅生产工艺流程如下: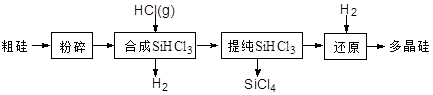
(1)粗硅粉碎的目的是 。分离SiHCl3 (l)和SiCl4(l)的方法为 。
(2)900℃以上, H2与SiHCl3发生如下反应:SiHCl3 (g)+ H2 (g)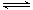 Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有 。
(3)该流程中可以循环使用的物质是 。
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) 2H2(g)
2H2(g)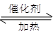 CH3OH(g)
CH3OH(g) Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
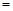 ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施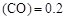 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v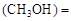 mol /(L·min),
mol /(L·min), CO2(g)
CO2(g)  2CO(g) 平衡常数K1
2CO(g) 平衡常数K1 H2O(g)
H2O(g)  CO(g)
CO(g) H2(g) 平衡常数K2
H2(g) 平衡常数K2 H2O(g)
H2O(g)  H2(g)
H2(g) CO2(g) 平衡常数K3
CO2(g) 平衡常数K3查看答案和解析>>
科目:高中化学 来源: 题型:填空题
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g);△H<0
2SO3(g);△H<0
(1)该反应450℃时的平衡常数 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0. 10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则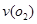 = mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”)
= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com