
��һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0��2 mol��N2��0��6 mol��H2����һ�������·������·�Ӧ��N2(g)��3H2(g) 2NH3(g)��Q��Q��0��,
2NH3(g)��Q��Q��0��,
��1���÷�Ӧ���õĴ����� ����д���ƣ�
�÷�Ӧ450���ƽ�ⳣ�� 500��ʱ��ƽ�ⳣ�����>������<����=������
��2��������������˵��������Ӧ�Ѵ�ƽ�����
| A��3V����H2����2V����NH3�� | B�������������ƽ������������ʱ����仯 |
| C��������������ܶȲ���ʱ����仯 | D������������ķ�����������ʱ����仯 |
| | A | B | C | D |
| �о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P1>P2�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
| ͼʾ |  |  |  |  |
��1������ý����
��2��B D
��3��0��01 mol/L
��4��C
���������������1���÷�Ӧ���õĴ����Ǵ�ý�����ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ����� �÷�Ӧ450���ƽ�ⳣ��Ӧ�ô���500��ʱ��ƽ�ⳣ����
��2�����������������ƽ����������������������ܶ����û��ƽ��ʼ���ڷ����ű仯����ѡBD��
��3�����ݷ�Ӧ���ʵļ��㹫ʽ�����v(N2)Ϊ0��01mol/(L¯min)��
��4��A����Ӧ������ļ�������������������ļ�������������ѹǿƽ��������Ӧ�����ƶ��������������������ѹǿԽ��Ӧ����Խ��ͼ������A����B������Ӧ���ȣ��������¶�ƽ�����淴Ӧ�����ƶ���������ת���ʽ��ͣ�ͼ������B����C�����ӵ���������Ӧ���������뵪��˲���淴Ӧ���ʲ��䣬Ȼ�����������´ﵽƽ��״̬��ͼ����ϣ���C��ȷ��D�������������Ӧ�������ﵽƽ������ʱ���٣�ͼ���ϣ���D����ѡC��
���㣺���⿼�黯ѧ��Ӧ���ʺ�ƽ��״̬���ж����⣬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
KI��Һ����������������������Ӧ����������ʵ���¼��
| ʵ���� | �� | �� | �� | �� | �� |
| �¶ȣ��棩 | 30 | 40 | 50 | 60 | 70 |
| ��ɫʱ�䣨s�� | 160 | 80 | 40 | 20 | 10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��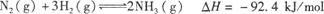 ���ݴ˻ش��������⣺
���ݴ˻ش��������⣺
��1���ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= ��
�ڸ����¶ȶԻ�ѧƽ���Ӱ����ɿ�֪�����ڸ÷�Ӧ���¶�Խ�ߣ���ƽ�ⳣ����ֵԽ ��
��2��ij�¶��£�����10 mol N2��30 mol H2�������Ϊ10 L���ܱ������ڣ���Ӧ�ﵽƽ��״̬ʱ����û�������а����������Ϊ20��������¶��·�Ӧ��K= (���÷�����ʾ)��
��˵���÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ)��
a�������ڵ��ܶȱ��ֲ��� b��������ѹǿ���ֲ���
c��v��(N2)=2v��(NH3) d�����������c(NH3)����
��3�����ںϳɰ���Ӧ���ԣ������й�ͼ��һ����ȷ����(ѡ�����) ��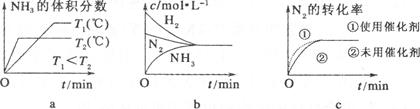
��4����ͬ�¶��£��к����ܱ�����A�ͺ�ѹ�ܱ�����B���������о�����1 mol N2��3 mol H2����ʱ�������������ȡ���һ�������·�Ӧ�ﵽƽ��״̬��A��NH3���������Ϊa���ų�����Q1kJ��B��NH3���������Ϊb���ų�����Q2kJ����a b(���������������=������ͬ)��Q1 Q2��Q1 92��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(14��)ij��ѧ��Ӧ2A(g) B(g)+D(g)�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ�㣬��Ӧ��A��Ũ��(mol/L)�淴Ӧʱ��(min)�ı仯����������������ݣ����������գ�
B(g)+D(g)�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ�㣬��Ӧ��A��Ũ��(mol/L)�淴Ӧʱ��(min)�ı仯����������������ݣ����������գ�
| ʵ�� ��� | �¶�/�� | ʱ��/min | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800�� | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800�� | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800�� | c 3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820�� | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����°������·������ʵ�顣
| ʵ���� | ��Ӧ�� | ���� |
| �� | 10mL2% H2O2��Һ | �� |
| �� | 10mL5% H2O2��Һ | �� |
| �� | 10mL5% H2O2��Һ | 1mL0.1mol��L��1FeCl3��Һ |
| �� | 10mL5% H2O2��Һ������HCl��Һ | 1mL0.1mol��L��1FeCl3��Һ |
| �� | 10mL5% H2O2��Һ������NaOH��Һ | 1mL0.1mol��L��1FeCl3��Һ |
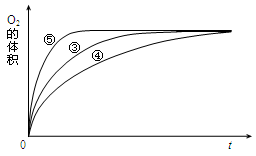
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
I.��¯��������Ҫ��ӦΪFe2O3��3CO2Fe��3CO2��
��֪�÷�Ӧ��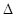 H����1000��ʱ��K=64����1000����������ݻ�10 L���ܱ������У�����Fe��Fe2O3��CO��CO2��1��OmoI����Ӧ��10 min��ﵽƽ�⡣
H����1000��ʱ��K=64����1000����������ݻ�10 L���ܱ������У�����Fe��Fe2O3��CO��CO2��1��OmoI����Ӧ��10 min��ﵽƽ�⡣
(1)��ʱ�䷶Χ�ڵ�ƽ����Ӧ����v(CO2��=_________mol/L min
min
(2) �����ת����_________________��
(3)�����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��_______________��
| A������Fe���� | B������Fe2O3���� |
| C�����߷�Ӧ�¶� | D���Ƴ�����CO2 |
 FeO��s��+CO��g������ƽ�ⳣ��ΪK1����ѧ��Ӧ�ڣ�Fe��s��+H2O��g��
FeO��s��+CO��g������ƽ�ⳣ��ΪK1����ѧ��Ӧ�ڣ�Fe��s��+H2O��g�� FeO��s��+H2��g������ƽ�ⳣ��K2�����¶�973K��1173K����£�K1��K2��ֵ�ֱ����£�
FeO��s��+H2��g������ƽ�ⳣ��K2�����¶�973K��1173K����£�K1��K2��ֵ�ֱ����£�| �¶� | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��25 ��ʱ���ϳɰ���Ӧ���Ȼ�ѧ����ʽΪ��N2��g��+3H2��g�� 2NH3��g�� ��H=��92.4 kJ/mol
2NH3��g�� ��H=��92.4 kJ/mol
���ڸ��¶�ʱ��ȡl mol N2��3 mol H2�����ܱ������У��ڴ��������½��з�Ӧ����÷�Ӧ�ų�����������_______92.4 kJ��(�С�ڡ��� �����ڡ� ���ڡ�)
��һ�������£��������淴Ӧ������̶����ܱ������н��У�����������˵����Ӧ�Ѵﵽƽ�����_______________��
| A��NH3���ɵ�������NH3�ֽ��������� |
B���������ķ�Ӧ���� v����NH3��=v����H2�� v����NH3��=v����H2�� |
| C�������ڵ��ܶȲ��ٱ仯 |
| D����λʱ��������a mol N2��ͬʱ����2a mol NH3 |
 ֵ��_____(����� ����С�� ���䡱)��
ֵ��_____(����� ����С�� ���䡱)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(14��)��ҵ���������Ҫ��Ӧ��4NH3(g)+5O2(g)  4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
(1)�����4molNH3��5molO2���������У��ﵽƽ��ʱ���ų�����0.8akJ����Ӧʱת�Ƶĵ�����Ϊ
mol
(2)�������������䣬���й�ϵͼ�д������ ��ѡ����ţ�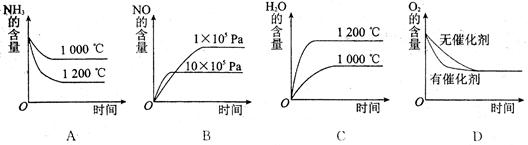
(3)t��ʱ�����ݻ��̶����ܱ������з���������Ӧ�������ڸ����ʵ�Ũ�����±�
| Ũ��(mol/L) ʱ��(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| �� ʼ | 4.0 | 5.5 | 0 | 0 |
| ��2min | 3.2 | x | 0.8 | 1.2 |
| ��4min | 2.0 | 3.0 | 2.0 | 3.0 |
| ��6min | 2.0 | 3.0 | 2.0 | 3.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��2 L�ܱ������У�800 ��ʱ��Ӧ2NO(g)��O2(g)  2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
| ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
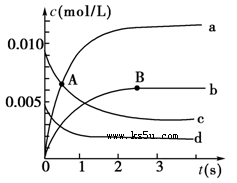
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com