
合成氨工业对国民经济和社会发展具有重要的意义。其原理为: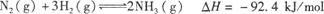 ,据此回答以下问题:
,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K= 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越 。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K= (可用分数表示)。
能说明该反应达到化学平衡状态的是 (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号) 。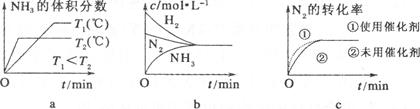
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a b(填“>”、“<”或“=”,下同),Q1 Q2,Q1 92.4。
(1)①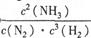 (2分) ②小(1分)
(2分) ②小(1分)
(2)1/12 (2分) bd (2分) (3)ac (2分) (4)< (2分) < (2分) <(2分)
解析试题分析:(1)①K为生成物浓度幂之积与反应物浓度幂之积的比,则K=c2(NH3)/c(N2)c3(H2)②该反应为热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小。
N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,2x/(1?x+3?3x+2x)×100%="20%" 解得x=1/3,平衡常数K=1/12; 由平衡的特征“等”、“定”可判定平衡,则a.容器的体积、气体的质量始终不变,则容器内的密度保持不变,不能判断平衡,故a错误;b.该反应为反应前后体积不等的反应,则容器内压强保持不变,达到平衡,故b正确;c.υ正(N2)=2υ逆(NH3),正逆反应速率不等,反应没有达到平衡,故c错误; d.混合气体中 c(NH3)不变,为平衡的特征,达到平衡,故d正确;(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故a正确;b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故b错误;c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故c正确;(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动,氨气的体积分数变大,所以a<b,B中放出的热量对,则Q1<Q2,热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4。
考点:化学平衡的计算;化学平衡常数的含义;化学反应速率的影响因素;化学平衡状态的判断;体积百分含量随温度、压强变化曲线;转化率随温度、压强的变化曲线。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
高炉炼铁过程中发生的主要反应为1/3Fe2O3(s) + CO(g) 2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=" _________" 、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
| A.减少Fe的量 |
| B.增加Fe203的量 |
| C.移出部分CO2 |
| D.提高反应温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题: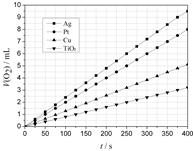
(1)已知:2H2O2(aq) =" 2" H2O (l) + O2(g) 的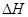 < 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
< 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
(2)某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃ 时,保持其它实验条件相同,测得生成的O2体积(V)。V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况),则:在不同催化剂存在下,H2O2分解反应的活化能大小顺序是 Ea( ) > Ea( ) > Ea( ) > Ea( ) (括号内填写催化剂的化学式)金属Pt 催化下,H2O2分解的反应速率v(O2) = mol·s-1
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度T,重复上述实验。获得V(O2) ~ T关系曲线。下列趋势图最可能符合实测V(O2) ~ T关系曲线的是 ,原因是 。
| A. | B. | C. | D. (4)以Pt为电极电解H2O2也可产生氧气,写出H2O2水溶液电解过程中的电极反应式(已知:H2O2的氧化性及还原性均比H2O强):阴极;阳极 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应: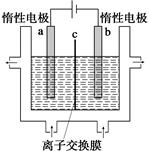
3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入 (阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用 (阴、阳)离子交换膜,在阳极发生的电极反应式: 。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g)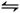 I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
①该反应属于( )
A.任何温度均自发 B.任何温度均不自发 C.高温自发 D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在某密闭容器内有正反应为放热的可逆反应,其中A、B为气体,C为固体,若反应开始经 s后达平衡。如图:
s后达平衡。如图:
(1)该反应的化学方程式为_________________________
(2)反应物的转化率______________________
(3)要使反应物的转化率增加可能的原因是____________
A.增大了B或C的浓度 B.使用了催化剂
C.缩小体积,使体系压强增大 D.升高了反应温度
(4)该反应达到平衡后,向该容器中再充入0.5mol的He。若恒温恒压,,这时反应速率 _________(填“加快”、“减慢”或“不变”),平衡_____________ (填“向正方向移动”、“向逆方向移动”、“不移动”);若恒温恒容时,这时反应速率_______(填“加快”、“减慢”或“不变”),反应物的转化率___________(填“加快”、“减慢”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
反应m A+n B p C在某温度下达到平衡
p C在某温度下达到平衡
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 。②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为______态。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,氢气的平均反应速率v(H2)为______________。
(2)该反应达到平衡时N2的转化率_________________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________。(填序号)
a.0.20 mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1 d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式_________,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>”、“="”" 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),
2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是 (填写名称)
该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是
| A.3V正(H2)=2V逆(NH3) | B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 | D.容器中气体的分子总数不随时间而变化 |
| | A | B | C | D |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10—3 mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com