
��1����һ���������İ�������������ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺
H2NCOONH4��s�� 2NH3��g��+CO2��g��
2NH3��g��+CO2��g��
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶ȣ��棩 | 15��0 | 20.0 | 25��0 | 30��0 | 35��0 |
| ƽ��������Ũ�ȣ���10��3 mol/L�� | 2��4 | 3��4 | 4��8 | 6.8 | 9��4 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��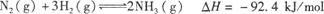 ���ݴ˻ش��������⣺
���ݴ˻ش��������⣺
��1���ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK= ��
�ڸ����¶ȶԻ�ѧƽ���Ӱ����ɿ�֪�����ڸ÷�Ӧ���¶�Խ�ߣ���ƽ�ⳣ����ֵԽ ��
��2��ij�¶��£�����10 mol N2��30 mol H2�������Ϊ10 L���ܱ������ڣ���Ӧ�ﵽƽ��״̬ʱ����û�������а����������Ϊ20��������¶��·�Ӧ��K= (���÷�����ʾ)��
��˵���÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ)��
a�������ڵ��ܶȱ��ֲ��� b��������ѹǿ���ֲ���
c��v��(N2)=2v��(NH3) d�����������c(NH3)����
��3�����ںϳɰ���Ӧ���ԣ������й�ͼ��һ����ȷ����(ѡ�����) ��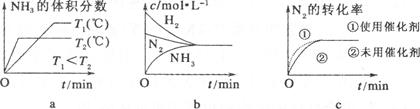
��4����ͬ�¶��£��к����ܱ�����A�ͺ�ѹ�ܱ�����B���������о�����1 mol N2��3 mol H2����ʱ�������������ȡ���һ�������·�Ӧ�ﵽƽ��״̬��A��NH3���������Ϊa���ų�����Q1kJ��B��NH3���������Ϊb���ų�����Q2kJ����a b(���������������=������ͬ)��Q1 Q2��Q1 92��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1��25 ��ʱ���ϳɰ���Ӧ���Ȼ�ѧ����ʽΪ��N2��g��+3H2��g�� 2NH3��g�� ��H=��92.4 kJ/mol
2NH3��g�� ��H=��92.4 kJ/mol
���ڸ��¶�ʱ��ȡl mol N2��3 mol H2�����ܱ������У��ڴ��������½��з�Ӧ����÷�Ӧ�ų�����������_______92.4 kJ��(�С�ڡ��� �����ڡ� ���ڡ�)
��һ�������£��������淴Ӧ������̶����ܱ������н��У�����������˵����Ӧ�Ѵﵽƽ�����_______________��
| A��NH3���ɵ�������NH3�ֽ��������� |
B���������ķ�Ӧ���� v����NH3��=v����H2�� v����NH3��=v����H2�� |
| C�������ڵ��ܶȲ��ٱ仯 |
| D����λʱ��������a mol N2��ͬʱ����2a mol NH3 |
 ֵ��_____(����� ����С�� ���䡱)��
ֵ��_____(����� ����С�� ���䡱)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(14��)��ҵ���������Ҫ��Ӧ��4NH3(g)+5O2(g)  4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
4NO(g)+6H2O(g)��H=-akJ/mol(a��0)
(1)�����4molNH3��5molO2���������У��ﵽƽ��ʱ���ų�����0.8akJ����Ӧʱת�Ƶĵ�����Ϊ
mol
(2)�������������䣬���й�ϵͼ�д������ ��ѡ����ţ�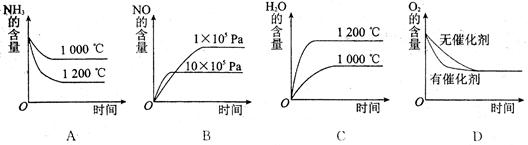
(3)t��ʱ�����ݻ��̶����ܱ������з���������Ӧ�������ڸ����ʵ�Ũ�����±�
| Ũ��(mol/L) ʱ��(min) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| �� ʼ | 4.0 | 5.5 | 0 | 0 |
| ��2min | 3.2 | x | 0.8 | 1.2 |
| ��4min | 2.0 | 3.0 | 2.0 | 3.0 |
| ��6min | 2.0 | 3.0 | 2.0 | 3.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
1200��ʱ���÷�Ӧ 2BBr3(g)+ 3H2(g) 2B(s) + 6HBr(g) ����ȡ���������������գ�
2B(s) + 6HBr(g) ����ȡ���������������գ�
��1������˵����˵���÷�Ӧ�ﵽƽ�����______��ѡ����ţ���ͬ����
a. v��(BBr3)= 3v��(HBr) b. 2c(H2) = c(HBr)
c.�ܱ�������ѹǿ���ٱ仯 d. ����������ƽ��Ħ���������ٱ仯
��2�����ܱ�����������䣬�����¶ȣ���������������ӣ�����˵����ȷ����_________��
a. ��ƽ���ƶ�ʱ����Ӧ������������С
b. ��ƽ���ƶ�ʱ�淴Ӧ����ʼ������
c. ����ӦΪ���ȷ�Ӧ
d. �ﵽ��ƽ���Ӧ�ﲻ��ת��Ϊ������
��3����������Ӧ��10L���ܱ������ڷ�Ӧ��5min����������������1.1 g�����ʱ�����������ƽ����Ӧ����Ϊ__________________��
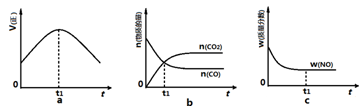
��4���������г���0.2 mol BBr3��һ����H2����ַ�Ӧ�ﵽƽ����������HBr�ٷֺ�������ʼͨ��H2�����ʵ�������ͼ��ϵ����a��b��c�����У�H2 ��ת������ߵ���______��ѡ����ĸ����b��ﵽƽ����ٳ���H2ʹƽ���c�㣬�˹�����ƽ���ƶ��ķ���Ϊ__________��������������ƶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʵ�� �����ܼ��š� �͡���̼���á���һ����Ҫ���������ν�CO2ת��Ϊ�����õ���Դ��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���һ�������·�����Ӧ��
CO2(g)+3H2(g) CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��
CH3OH(g)+H2O(g)����ͼ1��ʾ�÷�Ӧ����������(��λΪkJ��mol-1)�ı仯��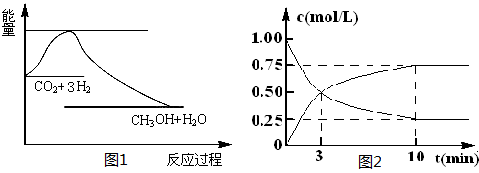
��1�����ڸ÷�Ӧ������˵���У���ȷ���� (����ĸ)��
A����H��0����S��0 B����H��0����S��0
C����H��0����S��0 D����H��0����S��0
��2��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊl L���ܱ������У�����l mol CO2��4mol H2��һ�������·�����Ӧ��CO2(g)+3H2(g) CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ2��ʾ��
CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ2��ʾ��
�ٴӷ�Ӧ��ʼ��ƽ�⣬CH3OH��ƽ����Ӧ����v(CH3OH) �� ��H2��ת����w(H2) = ��
�ڸ÷�Ӧ��ƽ�ⳣ������ʽK�� ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����� (����ĸ)��
A�������¶�
B����CH3OH(g)��ʱҺ�����
C��ѡ���Ч����
D���ٳ���l molCO2��4 molH2
��3��25�棬1.01��105Paʱ��16gҺ̬�״���ȫȼ�գ����ָ���ԭ״̬ʱ���ų�363.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��4��ѡ�ú��ʵĺϽ�Ϊ�缫�����������ơ��״���ˮ������Ϊԭ�ϣ������Ƴ�һ���Լ״�Ϊԭ�ϵ�ȼ�ϵ�أ��˵�صĸ���Ӧ�����ͨ��������� ���������ĵ缫��Ӧʽ�ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������ʵ�У�ʲô����Ӱ���˻�ѧ��Ӧ�����ʣ�
��1���ۻ���KClO3�ų����ݺ�������������MnO2�ܿ�������塣 ��
��2��ͬŨ�ȡ�ͬ����������з���ͬ����С��п����þ�������������п������� ��
��3��ͬ����С��ʯ��ʯ�ֱ���0.1mol��L-1�������1mol��L-1�������У���Ӧ���ʲ�ͬ�� ��
��4����ҵ�ϳ�������ȼ�Ϸ������ȼ�ա� ��
��5�������ʳƷ��ù�䣬����Ͳ����������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��2 L�ܱ������У�800 ��ʱ��Ӧ2NO(g)��O2(g)  2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
| ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣��������������������Ű�ҹ����ֵ���������ȼú������β������ɿ�����Ⱦ��ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO(g) + 2CO(g) 2CO2(g)+ N2(g)�����ܱ�����
2CO2(g)+ N2(g)�����ܱ�����
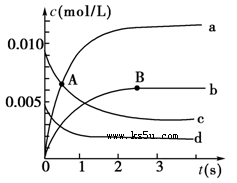
�з����÷�Ӧʱ��c(CO2)���¶�(T)��ʱ��(t)�ı仯������ͼ1��ʾ���ݴ��жϣ�
�ٸ÷�Ӧ�ġ�H 0���������������
����T2�¶��£�0��2s�ڵ�ƽ����Ӧ����v (N2)Ϊ ��
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ͼ2����ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� ������ĸ��ţ���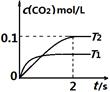
ͼ1 ͼ2
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⡣úȼ�ղ����������к������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4(g)+2NO2(g)��N2(g)��CO2(g)+2H2O(g)�� ��H����867 kJ/mol ��
2NO2(g) N2O4(g) ��H����56.9 kJ/mol ��
N2O4(g) ��H����56.9 kJ/mol ��
H2O(g)��H2O(l) ��H����44.0 kJ/mol ��
д��CH4����ԭN2O4(g)����N2��H2O(l)���Ȼ�ѧ����ʽ ��
��3������ȼ�ϵ�ؿ����������������ʡ���ͼ�����ü���ȼ�ϵ�ص��100mL 1 mol/Lʳ��
ˮ��װ�ã����һ��ʱ����ռ�����״���µ�����2.24L���������Һ������䣩��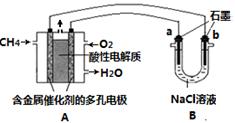
�ٸ�ȼ�ϵ�صĸ�����ӦʽΪ ��
�ڵ�����Һ��pHԼΪ ����������������������Һ��Ӧ����
�������������������ڱ�״����ԼΪ L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com