
��2 L�ܱ������У�800 ��ʱ��Ӧ2NO(g)��O2(g)  2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
| ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
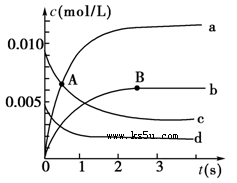
��1�����ڡ����ڡ���2��b��1.5��10��3mol/(L��s) ��3��bc����4��bcd
���������������1��NO�Ƿ�Ӧ���ʼŨ����0.020mol��2L��0.010mol/L����������c��ʾNO��Ũ�ȱ仯���ߡ�A��NO��Ũ�ȼ������ͣ�û�дﵽƽ��״̬����Ӧ��Ȼ��������Ӧ������еģ�����Ӧ���ʴ����淴Ӧ���ʣ�����A������Ӧ���ʴ���B������Ӧ���ʡ�
��2��NO2��������ڷ�Ӧ������Ũ��������ġ��ɱ������ݿ�֪��ƽ��ʱc��NO��=0.007mol/L��2L��0.0035mol/L������bƽ��ʱ��Ũ��Ϊ0.0035mol/L�����ݷ�Ӧ����ʽ�еĻ�ѧ��������֪������b��ʾNO2��Ũ�ȱ仯���ߡ���Ӧ���е�2s�ǣ�NOŨ�ȼ�����0.010mol/L��0.004mol/L��0.006mol/L������������Ũ�ȱ仯����0.003mol/L���������ķ�Ӧ������0.0030mol/L��2s��1.5��10��3mol/(L��s)��
��3����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬��a��ʼ�ն�����v��NO2����2v��O2����ϵ���ʲ���˵������ƽ�⣬��a����b���淴Ӧ������������ʵ�����С��ѹǿ��С�����������ѹǿ���ֲ���ʱ������˵������ƽ�⣬��b��ȷ��c����ͬ���ʱ�ʾ����������֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ����ƽ�⣬��v����NO��=2v����O2��������˵������ƽ�⣬��c��ȷ��d����Ӧ���������������䣬������������䣬�ܶ�ʼ�ղ��䣬�����������ʵ��ܶȱ��ֲ��䣬����˵������ƽ�⣬��d����ѡbc��
��4��a����ʱ�����NO2���壬ƽ��������Ӧ�ƶ�������Ӧ���ʽ��ͣ���a����b���ʵ������¶ȣ���Ӧ��������ƽ�����淴Ӧ�ƶ�����b��ȷ��c������O2��Ũ�ȣ���Ӧ��������ƽ��������Ӧ�ƶ�����c��ȷ��d��ѡ���Ч�Ĵ���������Ӧ���ʣ���Ӱ��ƽ���ƶ�����d��ȷ����ѡbcd��
���㣺����ƽ��״̬���жϡ���Ӧ���ʵļ����Լ���������Է�Ӧ���ʵ�Ӱ���
�����������Ǹ߿��еij������ͣ������е��Ѷȵ����⣬���������߿���������ǿ�����ض�ѧ�������������������ڵ���ѧ����ѧϰ��Ȥ������������ѧ���������������ʹ���˼ά�������ѵ���ƽ��״̬���жϣ�����ʱӦע��ƽ��״̬�ж�ѡ���жϵ���������Ӧ���ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д� Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0��2 mol��N2��0��6 mol��H2����һ�������·������·�Ӧ��N2(g)��3H2(g) 2NH3(g)��Q��Q��0��,
2NH3(g)��Q��Q��0��,
��1���÷�Ӧ���õĴ����� ����д���ƣ�
�÷�Ӧ450���ƽ�ⳣ�� 500��ʱ��ƽ�ⳣ�����>������<����=������
��2��������������˵��������Ӧ�Ѵ�ƽ�����
| A��3V����H2����2V����NH3�� | B�������������ƽ������������ʱ����仯 |
| C��������������ܶȲ���ʱ����仯 | D������������ķ�����������ʱ����仯 |
| | A | B | C | D |
| �о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P1>P2�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
| ͼʾ |  |  |  |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����һ���������İ�������������ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺
H2NCOONH4��s�� 2NH3��g��+CO2��g��
2NH3��g��+CO2��g��
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
| �¶ȣ��棩 | 15��0 | 20.0 | 25��0 | 30��0 | 35��0 |
| ƽ��������Ũ�ȣ���10��3 mol/L�� | 2��4 | 3��4 | 4��8 | 6.8 | 9��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������̼��̼�Ļ���������������ʵ����Ӧ�ù㷺��
(1)��2�����ܱ������У�����2mol CO��4mol ˮ�������ڴ��������½������»�ѧ��Ӧ��CO(g)+H2O(g) CO2(g)+H2(g)��CO��ת���ʺ��¶�t�Ĺ�ϵ���±���
CO2(g)+H2(g)��CO��ת���ʺ��¶�t�Ĺ�ϵ���±���
| t(��) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
 CH3OH(g)+H2O(g) ��H��-49.0 kJ��mol��1���������Ϊ1 L���ܱ������У�����
CH3OH(g)+H2O(g) ��H��-49.0 kJ��mol��1���������Ϊ1 L���ܱ������У�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
T��ʱ��A��B��C���������ڷ�Ӧ�����е�Ũ�ȱ仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT1���T2��ʱ��B��Ũ�ȱ仯��ʱ��Ĺ�ϵʾ��ͼ��ͼ2��ʾ��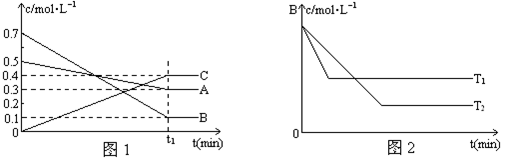
��ش��������⣺
��1���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ�ǣ�
��2���Ƚϴ�С��
A��B��ת����A B��ԭ����
�¶ȵĸߵ�T1 T2���ж�������
��3���������������䣬��Ӧ���е���t1+10��minʱ��A��Ũ��Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�Ӵ��������Ṥ���У�������Ӧ��450�沢�д��������½��У�
2SO2(g)��O2(g) 2SO3(g)����H<0
2SO3(g)����H<0
��1)�÷�Ӧ450��ʱ��ƽ�ⳣ�� 500��ʱ��ƽ�ⳣ��(����ڡ�����С�ڡ����ڡ�)��
��2)��һ���̶��ݻ�Ϊ5L���ܱ������г���0.20 mol SO2��0. 10molO2������Ӻ�ﵽƽ�⣬��������к�SO30.18mol����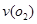 = mol.L-1.min-1��������ͨ��0.20mol SO2��0.10mol O2����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ���� ����)
= mol.L-1.min-1��������ͨ��0.20mol SO2��0.10mol O2����ƽ�� �ƶ�(�������Ӧ���������淴Ӧ���� ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
(14��)��ҵ������·ѭ����������������Ĺ�����������ͼ��ʾ��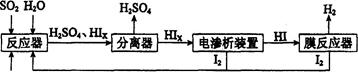
�ش��������⣺
��1���ڷ�Ӧ���з�����Ӧ�Ļ�ѧ����ʽ��______________��
��2����Ĥ��Ӧ���з�����Ӧ��2HI(g) H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��
H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��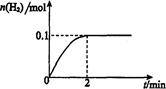
�ٸ��¶��£���Ӧƽ�ⳣ��K=_______���������¶ȣ�Kֵ��_______
(���������������?��)��
���û�ѧƽ��ԭ������ʹ��Ĥ��Ӧ����ʱ�����H2��Ŀ����___________________
��3��������װ������ͼ��ʾ��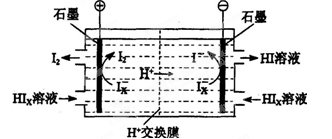
�ٽ�ϵ缫��Ӧʽ����������HIxת��ΪHI��ԭ����______________________________
�ڸ�װ���з������ܷ�Ӧ�Ļ�ѧ����ʽ��________________________
��4����������������ѭ�����õ�������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��15�֣�ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ��ԭ����2KMnO4 + 5H2C2O4 + 3H2SO4�� K2SO4 + 2MnSO4 + 10CO2�� + 8H2O
��ʵ�����ݼ���¼��
| ʵ���� | �����£��Թ��������Լ��������� / mL | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05mol/L KMnO4��Һ | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |

| ʵ���� | �����£��Թ��������Լ��������� / mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05 mol/L KMnO4��Һ | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
����ʯ����ѧʽ��ʾΪMgCO3��CaCO3��Ϊԭ���Ʊ�Mg(OH)2�Ĺ�����������ͼ��ʾ��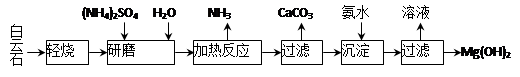
��1����ĥ�������� ��
��2���ù����п�ѭ��ʹ�õ������� �� ��д��ѧʽ����
��3������ʯ���յ���Ҫ������MgO��CaCO3������ͳ�����ǽ�����ʯ���ȷֽ�ΪMgO��CaO����ȡ������ʯ���յ��ŵ��� ��
��4�����ȷ�Ӧ�����ӷ���ʽΪ ��
��5���ټ��ȷ�Ӧʱ����323k��353k��Һ��c(NH4+)�뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ��������ͼ����373k�����ߡ�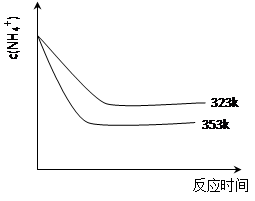
����ͼ��֪�������¶����ߣ� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com