
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:
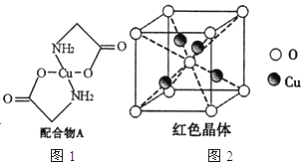
(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
【答案】 3d104s1 N〉O〉C sp2、sp3 8 N2O(或SCN-、N3-等) Cu2O
【解析】(1)Cu是29号元素,其原子核外有29个电子,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理知其基态原子外围电子排布式为3d104s1,故答案为:3d104s1;
(2)同周期从左到右,元素的第一电离能呈增大趋势,但N元素原子的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻的元素,所以C、N、O三种元素的第一电离能由由小到大的排列顺序是N>O>C;故答案为:N>O>C;
(3)配合物A分子中一种碳有C=O,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化;故答案为:sp3、sp2;
(4)共价单键为σ键,共价双键中一个是σ键一个是π键,H2N-CH2-COONa中含有8个σ键,所以1mol氨基乙酸钠中含有σ键的数目为8mol,故答案为:8;
(5)一个二氧化碳分子中原子个数为3个,价电子数为16,原子个数相等、价电子数相等的微粒为等电子体,则CO2的等电子体为:N2O(或SCN-、N3-等),故答案为:N2O(或SCN-、N3-等);
(6)利用均摊法知,该化合物中O原子个数=1+8×![]() =2,Cu原子个数=4,铜原子和氧原子个数之比=4:2=2:1,所以其化学式为:Cu2O,故答案为:Cu2O。
=2,Cu原子个数=4,铜原子和氧原子个数之比=4:2=2:1,所以其化学式为:Cu2O,故答案为:Cu2O。


科目:高中化学 来源: 题型:
【题目】(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是________________,属于电解质的是_________________。(填编号)
(2)节日焰火利用的是_________反应,城市射灯在夜空形成五颜六色的光柱,属于______效应。
(3)在 2Na2O2+2CO2===2Na2CO3+O2反应中,_________是还原剂,_________是氧化剂。若转移3mol电子,则所产生的O2在标准状况下的体积为_________。
(4)①除去铁粉中混用铝粉,选用的试剂为:___________;
②NaHCO3溶液中混有Na2CO3 选用的试剂为________________________;
③除去Na2CO3粉末中的NaHCO3 ,采用的方法___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年绵阳科博会场馆,大量的照明材料或屏幕都使用了发光的二极管(LED)。目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(氮化铟镓)为主。已知砷化镓的晶胞结构如图。试回答:
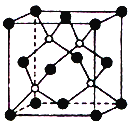
(1)镓的基态原子的外围电子排布式是_______________。
(2)镓与钾、钙元素的第一电离能从大到小依次为_________________________,与其在同一周期的砷、硒和溴的电负性从大到小依次为_______________。(填元素符号)
(3)此晶胞中所含的砷原子(白色球)个数为_______,与同一个镓原子相连的砷原子构成的立体构型为___________,镓采取的杂化方式为________________。
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为_____________________,其结构式为_____________,硼酸是_______元酸。
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为________cm,NA表示阿伏伽德罗常数,则该晶体的密度为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO32-的还原性大于I-的还原性,某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32-;④可能含有I-
A. ①③ B. ①②③ C. ③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应同时又是吸热反应的是()
A. Ba(OH)2·8H2O与NH4Cl反应
B. 铝与稀盐酸
C. 灼热的炭与水蒸气生成一氧化碳和氢气的反应
D. 煤与O2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,混合后得到密度为1.17 g·cm-3的溶液。请计算:
①混合后的溶液中NaCl的质量分数为__________________。
②混合后的溶液的物质的量浓度为___________。
③在1 000g水中需加入__________ mol氯化钠,才能使其浓度恰好与上述混合后的溶液的浓度相等(计算结果保留1位小数)。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为__________,混合气体的平均相对分子质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为____________ (计算结果保留1位小数) 。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_______________ (计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
(1)Ba(OH)2:_______________________________________。
(2)KHSO4:________________________________________。
(3)HNO3:_________________________________________。
(4)Na2CO3:_______________________________________。
(5)NaHCO3:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于标准状况下11.2L CO2的说法正确的是( )
A.质量为44gB.CO2物质的量为1mol
C.含有1mol氧原子D.CO2分子数为3.01×1024
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其用途相符合的是
①Cl2——自来水消毒剂 ②浓硫酸——干燥剂 ③AgI——人工降雨
④FeCl3——印刷电路板 ⑤淀粉——检验I2的存在 ⑥Na2O2——漂白纺织物
A. ②③④⑤⑥ B. ①②③④⑤ C. ②③④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com