
【题目】(1)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,混合后得到密度为1.17 g·cm-3的溶液。请计算:
①混合后的溶液中NaCl的质量分数为__________________。
②混合后的溶液的物质的量浓度为___________。
③在1 000g水中需加入__________ mol氯化钠,才能使其浓度恰好与上述混合后的溶液的浓度相等(计算结果保留1位小数)。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为__________,混合气体的平均相对分子质量为____________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为____________。
(4)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为____________ (计算结果保留1位小数) 。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_______________ (计算结果保留1位小数)。
【答案】 20% 4.0 mol·L-1 4.3 1∶1 51.5 44 g·mol-1 27.6% 48.3%
【解析】(1)①由题意,混合后溶液的质量为2.00g+30.0g=50.0g,则混合后NaCl的质量分数为:(20.0g×14%+30.0g×24%)÷50.0g×100%=20%;②混合后溶液中NaCl的物质的量浓度为:c=1000ρω/M=![]() molL-1=4.0mol·L-1;③设需加入NaCl的物质的量为n mol,则NaCl的质量为n mol×58.5g/mol=58.5n g,根据题意列式为:
molL-1=4.0mol·L-1;③设需加入NaCl的物质的量为n mol,则NaCl的质量为n mol×58.5g/mol=58.5n g,根据题意列式为: ![]() =20%,解得n≈4.3(计算结果保留1位小数)。
=20%,解得n≈4.3(计算结果保留1位小数)。
(2)由Cl2+H2![]() 2HCl,2H2+O2
2HCl,2H2+O2![]() 2H2O可知,氯气与氢气反应的体积比是1:1,氧气与氢气反应的体积比是1:2;设氯气的体积为x,则与氯气反应的氢气的体积也为x,氧气的体积为(100mL-x),与氧气反应的氢气的体积为2(100mL-x),所以,x+2(100mL-x)=150mL,解得:x=50mL,氧气的体积为100mL-50mL=50mL,所以,混合气体中Cl2和O2的体积之比为50mL:50mL=1:1.假设氯气和氧气各1摩尔,混合气体的平均摩尔质量为:(71g+32g)÷2mol=51.5g·mol-1,则混合气体的平均相对分子质量为51.5。
2H2O可知,氯气与氢气反应的体积比是1:1,氧气与氢气反应的体积比是1:2;设氯气的体积为x,则与氯气反应的氢气的体积也为x,氧气的体积为(100mL-x),与氧气反应的氢气的体积为2(100mL-x),所以,x+2(100mL-x)=150mL,解得:x=50mL,氧气的体积为100mL-50mL=50mL,所以,混合气体中Cl2和O2的体积之比为50mL:50mL=1:1.假设氯气和氧气各1摩尔,混合气体的平均摩尔质量为:(71g+32g)÷2mol=51.5g·mol-1,则混合气体的平均相对分子质量为51.5。
(3)根据PV=nRT,在T、V相同时,压强之比等于物质的量之比,即4:11=![]() :
: ![]() ,解得:M=44mol·L-1。
,解得:M=44mol·L-1。
(4)同温、同压下,气体密度之比等于相对分子质量之比,混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为14.5×2=29,CO、N2的相对分子质量都是28,可以看作CO和O2的混合气体,设CO、N2的总物质的量为xmol、O2的物质的量为ymol,则28x+32y=29(x+y),解得x:y=3:1,故氧气的质量分数=![]() ×100%≈27.6%(计算结果保留1位小数);其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为
×100%≈27.6%(计算结果保留1位小数);其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为![]() ×100%≈48.3%(计算结果保留1位小数)。
×100%≈48.3%(计算结果保留1位小数)。


科目:高中化学 来源: 题型:
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V形,如图所示(图中箭头代表单键)。下列有关该物质的说法中正确的是

A. 每个N5+中含有35个质子和36个电子 B. 该离子中只含有非极性键
C. 该离子中含有2个π键 D. N5+与PO43-互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2H2O2=2H2O+O2↑,若其他条件不变,下列措施不能加快该反应速率的是
A. 升高温度 B. 加入少量MnO2
C. 加入浓度更高的H2O2溶液 D. 加水稀释H2O2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式是 ( )
A. 氢氧化钡溶液与硝酸的反应:OH- + H+ = H2O
B. 澄清的石灰水与稀盐酸反应:Ca(OH)2 + 2H+ = Ca2+ + 2H2O
C. 铁片插入稀硫酸溶液中反应:2Fe + 6H+=2Fe3++3H2↑
D. 碳酸钡溶于稀盐酸中:CO![]() + 2H+ = H2O+CO2↑
+ 2H+ = H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:
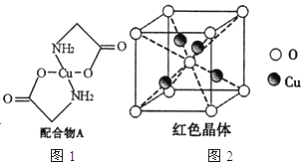
(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍:Y与Z能形成Z2Y、Z2Y2 型离子化合物,Z与T形成的Z2T化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断不正确的是( )

A. Y、Z组成的化合物只含离子键
B. 氢化物的沸点和稳定性排序:R
C. 最高价氧化物对应的水化物的酸性:T> R
D. 由X、Y、Z、T四种元素组成的化合物水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构示意图:

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_______。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为_____、______。
(3)C60属于_____晶体,石墨属于______晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的______共价键.而石墨层内的C-C间不仅存在_____共价键,还有______键。
(5)金刚石晶胞含有_____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a , 根据硬球接触模型,则r =_____a。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________。
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃; ③____________________________。
(3) 若pH过高,则对产品的影响是_________________________。
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,温度对有机污染物P—CP降解反应的影响如图所示。下列判断不正确的是( )

A. T1<T2
B. p—CP降解反应是吸热反应
C. 其他条件相同时,温度越高,反应速率越快
D. T1℃时,在50150 s之间p—CP的平均降解速率为1.6X10-5 mol L-1 s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com