
【题目】根据表中7种短周期元素的有关信息判断,下列说法错误的是![]()
![]()
元素编号 |
|
|
|
|
|
|
|
原子半径 |
|
|
|
|
|
|
|
最高化合价或最低化合价 |
|
|
|
|
|
|
|
A. 元素![]() 气态氢化物的稳定性大于元素
气态氢化物的稳定性大于元素![]() 气态氢化物的稳定性
气态氢化物的稳定性
B. 元素![]() 氢化物的沸点小于元素
氢化物的沸点小于元素![]() 氢化物的沸点
氢化物的沸点
C. 元素![]() 形成的化合物具有两性
形成的化合物具有两性
D. ![]() 可形成离子化合物
可形成离子化合物
【答案】B
【解析】
根据最高化合价或最低化合价可以判断,①⑦为同主族,按照原子半径大小比较规律,①为H,⑦为Na,②和⑤为同一主族,属于VIA族元素,即②为O,⑤为S,③和⑥属于同主族,属于第ⅢA族元素,③为B,⑥为Al,④的最低价为-1价,原子半径比②的大,则④为Cl;
根据最高化合价或最低化合价可以判断,①⑦为同主族,按照原子半径大小比较规律,①为H,⑦为Na,②和⑤为同一主族,属于VIA族元素,即②为O,⑤为S,③和⑥属于同主族,属于第ⅢA族元素,③为B,⑥为Al,④的最低价为-1价,原子半径比②的大,则④为Cl;
A、④为Cl,⑤为S,Cl的非金属性强于S,则HCl的稳定性强于H2S,故A说法正确;
B、②的氢化物无论是H2O,还是H2O2,常温下都是液体,⑤的氢化物为H2S,常温下为气体,则元素②氢化物的沸点高于元素⑤氢化物的沸点,故B说法错误;
C、元素②和⑥形成的化合物是Al2O3,属于两性氧化物,故C说法正确;
D、⑦和①形成的化合物是NaH,属于离子化合物,故D说法正确,答案选B。


科目:高中化学 来源: 题型:
【题目】石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)
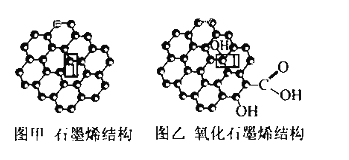
(1)图甲中,1号C与相邻C形成![]() 键的个数为________。
键的个数为________。
(2)图乙中,1号C的杂化方式是________,该C与相邻C形成的键角________(填 “>”“<”或“ = ”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
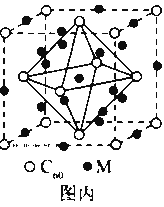
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示, M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修3:物质结构与性质]磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性元件。
(1)基态铜原子的电子排布式为_____;高温时氧化铜会转化为氧化亚铜,原因是____________________________________。
(2)元素周期表第3周期中,第一电离能比P小的非金属元素是_______(填元素符号)。
(3)N、P、As同主族,三种元素最简单氢化物沸点由低到高的顺序为____________,原因是____________________________________。
(4)某直链多磷酸钠的阴离子呈如图1所示的无限单链状结构,其中磷氧四面体通过共用顶点的氧原子相连,则P原子的杂化方式为_____,该多磷酸钠的化学式为______。

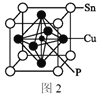
(5)某磷青铜晶胞结构如图2所示。
①则其化学式为______。
②该晶体中距离Sn原子最近的Cu原子有____个。
③若晶体密度为8.82 g·cm-3,最近的Cu原子核间距为______pm(用含NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双键完全共轭(单键与双键相间)的单环多烯烃称为轮烯,[8]轮烯(![]() )是其中的一种。下列关于该化合物
)是其中的一种。下列关于该化合物
的说法错误的是( )
A. 与苯乙烯互为同分异构体 B. 能使酸性高锰酸钾溶液褪色
C. 二氯代物有四种 D. 生成 1 mol C8H16 至少需要 4 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列物质分别加入盛水的锥形瓶,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如如图所示变化( )

① NH4NO3晶体 ② 浓H2SO4 ③ NaOH粉末
④ NaCl晶体 ⑤ Na2O2固体 ⑥ 生石灰
A. ①②④⑤ B. ①②③
C. ③④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:

(1)常温下含氢质量分数最高的气态烃是______(填字母)。
(2)写出E失去一个氢原子后所得烃基的结构筒式:______________。
(3)一卤代物种类最多的是_______(填字母)。
(4)写出实验室制取D的化学方程式:________________。
(5)写出F发生硝化反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)北京市场销售的某种食用精制盐包装袋上有如下说明:

Ⅰ.碘酸钾与碘化钾在稀硫酸酸化条件下发生如下反应:KIO3+5KI+ 5H2SO4=3K2SO4+ 3I2+3H2O
甲乙两位同学分别用不同的方法配制所需的100mL 3.6molL﹣1的稀硫酸。
(1)若采用18molL﹣1的浓硫酸配制溶液,需要用量筒量取浓硫酸的体积为_______mL;
(2)甲学生:量取浓硫酸,在烧杯中稀释,冷却至室温后转移到100mL容量瓶中,洗涤,然后定容,塞好瓶塞,反复上下颠倒摇匀。配制过程中多次用到玻璃棒,其主要作用是______________________。
(3)若实验中进行下列操作使硫酸溶液的物质的量浓度偏高的是_____________。
①定容时观察液面俯视②未经冷却趁热将溶液注入容量瓶中
③摇匀后发现液面低于刻度线再加水④容量瓶中原有少量蒸馏水
(4)乙学生:用100mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加水至100mL刻度线,搅拌均匀,你认为此法是否正确?若不正确,指出其中错误之处__________________。
Ⅱ.已知上述反应生成的I2可发生如下反应:I2+2S2O32—=2I-+S4O62—。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取w g食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为1.0×10-3mol/L 的Na2S2O3溶液20.0 mL,恰好反应完全。
(1)b中反应所产生的I2的物质的量是________ mol。
(2)根据以上实验和包装袋说明,所测精制盐的碘含量是_______________ mg/kg。(以含w的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:

已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com