
【题目】石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)
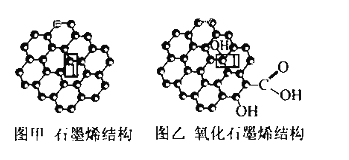
(1)图甲中,1号C与相邻C形成![]() 键的个数为________。
键的个数为________。
(2)图乙中,1号C的杂化方式是________,该C与相邻C形成的键角________(填 “>”“<”或“ = ”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
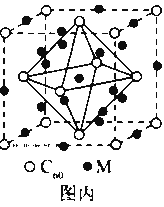
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示, M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
【答案】3sp3<O、H12M3C60
【解析】
(1)由图可知,甲中,1号C与相邻C形成3个C-C键,形成σ键的个数为3,故答案为:3;
(2)图乙中,1号C形成3个C-C及1个C-O键,C原子以sp3杂化,为四面体构型,而石墨烯中的C原子杂化方式均为sp2,为平面结构,键角为120,则图乙中C与相邻C形成的键角<图甲中1号C与相邻C形成的键角,故答案为:sp3;<;
(3)水中的O电负性较强,吸引电子能力的强,易与氧化石墨烯中的O-H上的H形成氢键,氧化石墨烯中O与水中的H形成氢键,故答案为:O、H;
(4)M原子位于晶胞的棱上与内部,棱上有12个M,内部有9个M,其个数为12×![]()
+9=12,C60分子位于顶点和面心,C60分子的个数为8×+6×![]() =4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,故答案为:12;M3C60.
=4,M原子和C60分子的个数比为3:1,则该材料的化学式为M3C60,故答案为:12;M3C60.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各为0.4mol。将A通入溴的四氯化碳溶液中,溶液褪色。试回答:
(1)烃A的电子式为:___________________________。
(2)若取一定量的该烃A在一定量的氧气中燃烧后,生成CO2和H2O的物质的量分别为0.1mol和0.3mol,同时还有CO生成,则在燃烧时消耗标准状况下氧气的体积___________________L。
(3)将A通入溴的四氯化碳溶液中,生成的产物的名称为______________________________。
(4)可以用来除去乙烷中混有的A的试剂是______________(填序号)。
①水 ②氢气 ③溴水 ④酸性高锰酸钾溶液
(5)有机物B比A在分子组成上多一个CH2原子团,结构与A相似。写出B在一定条件下生成高分子化合物的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程有热量放出的是( )
A. 化学反应中形成氢气中的HH键
B. C(s)与H2O(g)反应
C. H2O(l)转化为H2O(s)
D. H2O2分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式_____。
(2)TiCl4熔点是﹣25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4﹣中B原子的杂化类型为_____。
(3)在 TiO2催化作用下,可将CN﹣氧化成CNO﹣,进而得到N2。与CNO﹣互为等电子体的分子化学式为(只写一种)________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色)。绿色晶体中配体是_______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为______。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为ρgcm﹣3,阿伏加德罗常数为NA,则该晶胞的边长为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于某些离子的检验及结论中一定正确的
A. 加入稀盐酸产生无色的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3S + 6KOH = 2K2S + K2SO3+ 3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是:
A.1∶2B.2∶1C.1∶3D.3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂,一些性质及制备方法如下:
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为______________。
(2)弯曲的a管所起的作用是_____________;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是____________________。
(3)导管b 口应与 (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定分析:
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为________%。
(5)由上分析数据和计算得出结论:用此装置制得的无水氯化铁含铁最偏高,显然其中含有较多的FeCl2杂质。
①产生FeCl2杂质的原因是___________________。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中7种短周期元素的有关信息判断,下列说法错误的是![]()
![]()
元素编号 |
|
|
|
|
|
|
|
原子半径 |
|
|
|
|
|
|
|
最高化合价或最低化合价 |
|
|
|
|
|
|
|
A. 元素![]() 气态氢化物的稳定性大于元素
气态氢化物的稳定性大于元素![]() 气态氢化物的稳定性
气态氢化物的稳定性
B. 元素![]() 氢化物的沸点小于元素
氢化物的沸点小于元素![]() 氢化物的沸点
氢化物的沸点
C. 元素![]() 形成的化合物具有两性
形成的化合物具有两性
D. ![]() 可形成离子化合物
可形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com