
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式_____。
(2)TiCl4熔点是﹣25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4﹣中B原子的杂化类型为_____。
(3)在 TiO2催化作用下,可将CN﹣氧化成CNO﹣,进而得到N2。与CNO﹣互为等电子体的分子化学式为(只写一种)________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色)。绿色晶体中配体是_______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为______。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为ρgcm﹣3,阿伏加德罗常数为NA,则该晶胞的边长为___cm。
【答案】 3d24s2 分子 sp3 CO2(或N2O、CS2、BeCl2等) Cl﹣、H2O [TiO]n2n+ ![]()
【解析】(1)Ti的原子序数为22,Ti原子核外有22个电子,根据构造原理书写其外围电子排布式。
(2)TiCl4的熔沸点较低,可溶于苯或CCl4等非极性溶剂,TiCl4晶体属于分子晶体。BH4-中中心原子B上的孤电子对数=![]() (3+1-4
(3+1-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
(3)用“替换法”书写等电子体。
(4)绿色晶体的化学式为[TiCl(H2O)5]Cl2·H2O,绿色晶体的配体为Cl-和H2O。
(5)根据结构,其中Ti与O之比为1:1,Ti元素的化合价为+4价,O元素的化合价为-2价,钛酰离子的化学式为[TiO]n2n+。
(6)由晶体的密度和1mol晶体的质量计算1mol晶体的体积,用“均摊法”确定晶胞中粒子的个数,计算晶胞的体积,应用几何知识计算晶胞的边长。
(1)Ti的原子序数为22,Ti原子核外有22个电子,根据构造原理,基态Ti原子的核外电子排布式为1s22s22p63s23p63d24s2,Ti的基态原子的外围电子排布式为3d24s2。
(2)TiCl4的熔沸点较低,可溶于苯或CCl4等非极性溶剂,TiCl4晶体属于分子晶体。BH4-中中心原子B上的孤电子对数=![]() (3+1-4
(3+1-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
(3)用“替换法”,与CNO-互为等电子体的分子的化学式为CO2、N2O、CS2、BeCl2等。
(4)绿色晶体的化学式为[TiCl(H2O)5]Cl2·H2O,绿色晶体的配体为Cl-和H2O。
(5)根据结构,其中Ti与O之比为1:1,Ti元素的化合价为+4价,O元素的化合价为-2价,钛酰离子的化学式为[TiO]n2n+。
(6)1mol金属Ti的质量为48g,1mol金属Ti的体积为48g![]() ρg/cm3=
ρg/cm3=![]() cm3;用“均摊法”,1个晶胞中含Ti的个数为8
cm3;用“均摊法”,1个晶胞中含Ti的个数为8![]() +6
+6![]() =4;晶胞的体积为
=4;晶胞的体积为![]() cm3
cm3![]() NA
NA![]() 4=
4=![]() cm3;span>晶胞的边长为
cm3;span>晶胞的边长为![]() cm。
cm。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应:aX(g)+bY(g)![]() cZ(g)达到平衡时测得平衡常数为K1;保持温度不 变,将容器体积减小一半,当达到新平衡后,测得Y的浓度为原来的1.6倍,平衡常数为K2,则
cZ(g)达到平衡时测得平衡常数为K1;保持温度不 变,将容器体积减小一半,当达到新平衡后,测得Y的浓度为原来的1.6倍,平衡常数为K2,则
A. 平衡向正反应方向移动,K2>K1
B. 新平衡时Y的浓度增大,平衡向逆反应方向移动K1>K2
C. 新平衡时,Z的浓度大于原平衡2倍,K1=K2
D. 反应过程中,化学反应速率同等程度增大,K1=K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键的断裂有均裂和异裂两种方式,即均裂:AB―→A![]() ,异裂:AB―→A++[B]-。下列化学反应中发生共价键均裂的是( )
,异裂:AB―→A++[B]-。下列化学反应中发生共价键均裂的是( )
A. 2K+2H2O===2KOH+H2↑
B. 2Na+2C2H5OH―→2C2H5ONa+H2↑
C. Na2CO3+H2O![]() NaHCO3+NaOH
NaHCO3+NaOH
D. CH3COOH+C2H5OH![]() H2O+CH3COOC2H5
H2O+CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式___________________。

(2)已知:N2(g)+O2(g)=2 NO(g) △H=+178 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-743kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=_______kJ·mol-1
(3)在一固定容积为2L的密闭容器内加入1.5 mol的N2和5 mol的H2,在一定条件下发生如下反应:N2+3H2![]() 2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
2NH3,若第5分钟时达到平衡,此时测得NH3的物质的量为2mol,则前5分钟的平均反应速率υ(N2)为_________,平衡时H2的转化率为_________,该反应的平衡常数K=__________。
(4)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____;在压强一定的密闭容器中能说明合成氨反应一定达到平衡状态的是_____
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变 d. 混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 在标准状况下,11.2L O2和22.4L NO混合并充分反应后得到的气体的分子数为NA
B. 常温下0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA
C. 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
D. 25℃时,1.0L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)
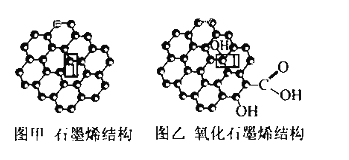
(1)图甲中,1号C与相邻C形成![]() 键的个数为________。
键的个数为________。
(2)图乙中,1号C的杂化方式是________,该C与相邻C形成的键角________(填 “>”“<”或“ = ”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
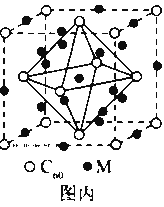
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示, M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是 ( )
A.K+、Na+、S2-、MnO4-B.Na+、NH4+、SO42-、Cl-
C.Fe3+、Mg2+、NO3-、SCN-D.NO3-、H+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com