
����Ŀ��ijУ��ѧ����С��Ϊ�˼���̼���ƺ�̼���������ְ�ɫ���壬�ò�ͬ�ķ���������ʵ�飬��ͼ��ʾ��
��1��ֻ����ͼI��II��ʾʵ�飬�ܹ��ﵽʵ��Ŀ�ĵ���______________����װ����ţ�2�֣���
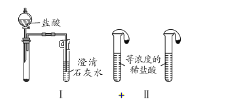
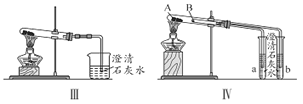
��2��ͼIII��IV��ʾʵ����ܼ������������ʣ����漰�Ļ�ѧ����ʽ��__________��______��
��3����ʵ��III�Աȣ�ʵ��IV���ŵ���________________����ѡ����ţ���
A. IV��III���� B. IV��III��ȫ
C. IV��III������� D. IV����������ͬһ��װ��ͬʱ���������Ա�ʵ�飬��III����
��4������ʵ������֤̼���ƺ�̼�����Ƶ��ȶ��ԣ����Թ�B��װ��Ĺ��������_____���ѧʽ����
��5����0.4 g NaOH��1.06 g Na2CO3��ϲ������Һ������Һ�еμ�0.1 mol��L��1��ϡ���ᡣ����ͼ������ȷ��ʾ������������������CO2�����ʵ����Ĺ�ϵ����__����������ѡ�
A. 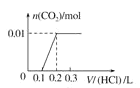 B.
B. 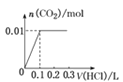
C. 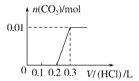 D.
D. 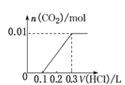
���𰸡�II 2NaHCO3=Na2CO3+CO2��+H2O CO2+Ca(OH)2=CaCO3+H2O D NaHCO3 C
��������
(1)ͨ�����Ũ�ȵ��������Ƚ��������ᷴӦ�����ʿ�����
(4)NaHCO3�����ֽ⣬�������Զ���Դ�¶Ƚϵ͵Ļ����зֽ⣬����Na2CO3�ڿ�����Դ�¶ȽϸߵĻ������Բ��ֽ⣬���ܱȽ������ȶ��IJ��죻
(5)NaOH��Na2CO3�Ļ����Һ�У��������ᣬH���Ⱥ�OH����Ӧ���ٺ�CO32����Ӧ������CO32����H����Ӧ������HCO3����HCO3����H����Ӧ����CO2��H2O��
(1)ͨ��ʵ��Ƚ�Na2CO3��NaHCO3�����ᷴӦ���ʵĿ�����ʵ������Ҫ�������Ũ����ͬ����ͨ���Ƚ�������Ŀ������Ƚ����ʣ����ܴﵽʵ��Ŀ�ģ�
(2)ͼ������NaHCO3��Na2CO3�����ȶ����йأ�NaHCO3�����ֽ⣬�仯ѧ����ʽΪ2NaHCO3![]() Na2CO3+CO2��+H2O��CO2+Ca(OH)2=CaCO3��+H2O��
Na2CO3+CO2��+H2O��CO2+Ca(OH)2=CaCO3��+H2O��
(3)��Ƚ�ʵ���ʵ���ֻҪ����һ�Σ�����ʵ��ʵ��Ŀ�ģ���ʵ�����Ҫ����2�Σ����D������
(4)NaHCO3�����ֽ⣬�������Զ����Դ�¶Ƚϵ͵Ļ����зֽ⣬����Na2CO3�ڿ�����Դ�¶ȽϸߵĻ������Բ��ֽ⣬���ܱȽ������ȶ��IJ��죻�Թ�BԶ����Դ�����װ��NaHCO3���壻
(5) NaOH��Na2CO3�Ļ����Һ�У��������ᣬH���Ⱥ�OH����Ӧ���ٺ�CO32����Ӧ���Ⱥ����ķ�Ӧ�����ӷ���ʽΪH����OH��=H2O��H����CO32��=HCO3����HCO3����H��=CO2����H2O��ֻ�����һ����Ӧ�����������ɡ�
0.4gNaOH�������ʵ���Ϊ0.01mol�����ĵ�HCl�����ʵ���Ϊ0.1mol�����Ϊ![]() ��1.06 g Na2CO3�������ʵ���Ϊ0.01mol��CO32����H����Ӧ������HCO3�������ĵ�HCl�����ʵ���Ϊ0.01mol�����Ϊ
��1.06 g Na2CO3�������ʵ���Ϊ0.01mol��CO32����H����Ӧ������HCO3�������ĵ�HCl�����ʵ���Ϊ0.01mol�����Ϊ![]() ��HCO3����H����Ӧ����CO2��H2O�����ĵ�HCl�����ʵ���Ϊ0.01mol�����Ϊ
��HCO3����H����Ӧ����CO2��H2O�����ĵ�HCl�����ʵ���Ϊ0.01mol�����Ϊ![]() ��ͬʱ����0.01molCO2��ֻ�����һ����Ӧ�����������ɣ���˿�ʼ������0.2L������Һ��û���������ɣ��������0.1L������Һ������0.01molCO2��ͼ��C���ϡ�
��ͬʱ����0.01molCO2��ֻ�����һ����Ӧ�����������ɣ���˿�ʼ������0.2L������Һ��û���������ɣ��������0.1L������Һ������0.01molCO2��ͼ��C���ϡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������ȵĹ��嵥�ʼ����Ի�ɫ��Ũ����Һ�У����ҷ�Ӧ�������������A��A�ڳ����²���������ã���������ͼ��ʾ�ı仯��

��д���������ʵĻ�ѧʽ��
��__________��B____________��C__________�� D____________��
��д�����ҷ�Ӧ�Ļ�ѧ����ʽ��__________________________��
�۵��ʱ�����Һ�ҷ�Ӧ��������B�����ӷ���ʽ��___________________��
��2����ͼ�Ǹ����ʵķ�Ӧ��ϵͼ����֪A��E���ǻ�ɫ��ĩ��F�д̼�����ζ����Ư���ԡ���ݴ˻ش��������⣺

д��ͼ�б�ŵĻ�ѧ����ʽ��
��_______________________��
��_______________________��
��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ����ɫ���壬TΪ������ʹ����㷺�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬C����ɫ��ζ�����壬H�ǰ�ɫ������

��1������A�Ļ�ѧʽΪ ________��
��2��H�ڳ�ʪ�����б��M��ʵ��������______________________________________����ѧ����ʽΪ___________________________________________��
��3��A��ˮ��Ӧ����B��C�����ӷ���ʽΪ___________________________________���ɴ˷�Ӧ��֪A����Ϊ_________����;��
��4������ٵ����ӷ���ʽ_______________________________________����д�����鲽��ٵõ�����Һ����Ҫ�����ӣ���H+�⣩����Ҫ���Լ���_____________��____________���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�������ȷ�Ӧʵ�顣����˵������ȷ������ ��

A���÷�Ӧ�ķ���ʽ��2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
B���÷�Ӧ�������£�����ǿ��
C���������ȷ�Ӧԭ��������ұ��ijЩ����
D������Ӧ��ת��3 mol���ӣ������������������ʵ�����1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��һ�������ɷ�������������ѧ��Ӧ����Fe+H2SO4(ϡ)=FeSO4+H2������2Fe+6H2SO4(Ũ) ![]() Fe2(SO4)3+3SO2��+6H2O���Իش��������⣺
Fe2(SO4)3+3SO2��+6H2O���Իش��������⣺
��1����Ӧ����__Ԫ�أ���Ԫ�����ƣ�����ԭ����������Ϊ____��
��2����Ӧ���л�ԭ����Ϊ__���÷�Ӧ�У��������뻹ԭ��֮��Ϊ___��
��3������£�����Ӧ��������33.6LSO2����ʱ����������Fe��___mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����A��B�������2L���ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)+2D(g)��5min����c(D)=0.5mol/L��c(A):c(B)=1:2��C�ķ�Ӧ������ 0.15 mol/(Lmin)��
xC(g)+2D(g)��5min����c(D)=0.5mol/L��c(A):c(B)=1:2��C�ķ�Ӧ������ 0.15 mol/(Lmin)��
��1��B�ķ�Ӧ����v(B)=_____X=___
��2��A��5minĩ��Ũ����___
��3����ʱ�����ڵ�ѹǿ�뿪ʼʱ֮��Ϊ��____��
��4�����Ȼ���(S2Cl2)��һ������ɫҺ�壬�Ǻϳ���Ⱦ�ϵ���Ҫԭ�ϡ�д�����ĵ���ʽ______��
��5������ԭ������Ϊ34�����ĵ��ʼ��仯������;�dz��㷺��
a.����Ԫ�����ڱ��е�λ����___��Se2Cl2�����������Լ�����ṹʽΪ___��
b.��������һ�ֿ�Ӧ����δ�������豸�����Ͱ뵼����ϡ���֪��(In)����ͬ���ұ������������Ӳ㡣����˵����ȷ����___������ĸ����
A��ԭ�Ӱ뾶��In>Se B��In�Ľ����Ա�Seǿ
C��In�Ľ����Ա�Al�� D���������Ļ�ѧʽΪInSe2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��![]() ��
��![]() ����
����![]() ��
��![]() �����Һ��ͨ������
�����Һ��ͨ������![]() ����Һ��ijЩ���ӵ����ʵ����仯��ͼ��ʾ������˵������ȷ�ģ� ��
����Һ��ijЩ���ӵ����ʵ����仯��ͼ��ʾ������˵������ȷ�ģ� ��
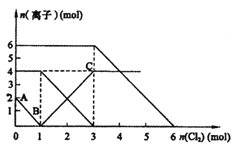
A.ͨ��������Ӧ���Ƚϻ�ԭ��ǿ��![]()
B.ԭ���Һ��![]()
C.ԭ���Һ��![]()
D.ͨ��![]() ʱ����Һ�з��������ӷ�Ӧ����ʽΪ
ʱ����Һ�з��������ӷ�Ӧ����ʽΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��һ����Ҫ�ķ�Ӧ���밴Ҫ�����������Ŀ��
��1���Է�ӦNH3+O2����NO+H2O(δ��ƽ)���������÷�Ӧ�У�________�ǻ�ԭ����________�ǻ�ԭ�������ԭ��������________��
��2����һ�������£���Ӧ2NH3+3CuO![]() 3Cu+N2+3H2O��˳�����У��Դ˷�Ӧ�ķ�����������________��
3Cu+N2+3H2O��˳�����У��Դ˷�Ӧ�ķ�����������________��
�ٸ÷�Ӧ���û���Ӧ
�ڷ�Ӧ��NH3������ΪN2
���ڷ�Ӧ�������˽���ͭ�Ļ�ԭ��
�ܸ÷�Ӧ��CuO��Ϊ���������뷴Ӧ
��3�� ��ƽ��Ӧ��____H2S+___SO2=____S+____H2O��
���У���������Ϊ________����ԭ��Ϊ________��������Ϊ______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com