
| A. | 食盐既可以做调味剂,又可以做防腐剂 | |
| B. | 纯碱既可以做清洗品,又可以做发酵粉 | |
| C. | 漂白粉既可以做消毒剂,又可以做漂白剂 | |
| D. | 酒精既可以做饮料,又可以做燃料 |
分析 A.食盐它可以使细菌细胞脱水死亡,所以可以杀菌;
B.纯碱性质稳定受热不分解;
C.次氯酸钠具有强氧化性,能杀菌消毒,且具有漂白性;
D.乙醇具有特殊香味,能够燃烧.
解答 解:A.食盐它可以使细菌细胞脱水死亡,所以可以杀菌,可作为防腐剂,食盐具有咸味是咸味剂,故A正确;
B.纯碱性质稳定受热不分解,碳酸氢钠不稳定受热分解生成二氧化碳,可以做发酵粉,故B错误;
C.漂白粉次氯酸根离子具有强的氧化性,具有漂白性和杀菌消毒作用,既可以做消毒剂,又可以做漂白剂,故C正确;
D.乙醇具有特殊香味,能够燃烧,所以酒精既可以做饮料,又可以做燃料,故D正确;
故选:B.
点评 本题考查了元素化合物知识,侧重考查物质的用途,明确相关物质的性质是解题关键,注意对相关知识的积累,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
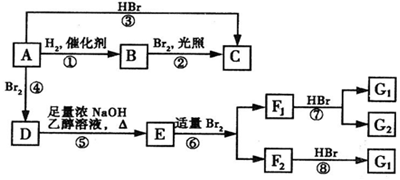
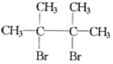 ,F1和F2互为同分异构体,G1和G2互为同分异构体.)
,F1和F2互为同分异构体,G1和G2互为同分异构体.)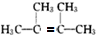 .
.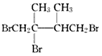 .
.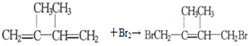 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7 | |
| C. | 若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 | |
| D. | 1.0×10-3mol•L-1盐酸的pH=3.0;1.0×10-8mol•L-1盐酸的pH=8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
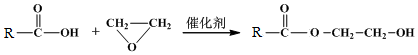
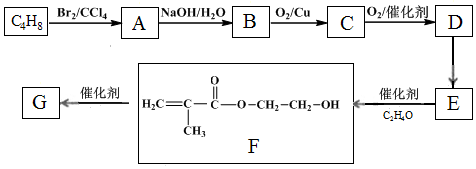
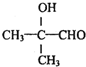 .
.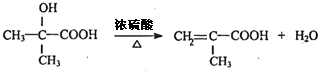 .
.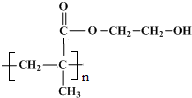 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验1 | 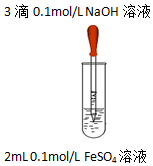 | 实验现象 |
| 液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
| 试管中10mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
| 实验2 | 6mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
| 实验3 | 6mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com