
【题目】短周期元素P、Q、X、Y、Z原子序数逐渐增大。它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1) Z的价电子排布式为____________,QZ3分子的空间构型为____________;
(2) X与Z构成的分子是_________分子(填“极性”或“非极性”)
(3) P和Y形成的化合物,其分子中包含__________键(填个数及 “σ键和π键”),该分子中P原子的杂化方式为____________,
(4) 写出一个验证Y与Z的非金属性强弱的离子反应方程式_________________;
(5) 金属镁在Q的单质中燃烧得到的产物与水反应生成两种碱性物质,该反应的化学方程式是____________________________________。
【答案】(1)3s23p5三角锥形
(2)非极性
(3)2个σ键 2个π键 sp
(4)H2S+Cl2═2H++2Cl-+S↓
(5)Mg3N2+6H2O═3Mg(OH)2+2NH3↑
【解析】试题分析:P、Q、X、Y、Z是短周期元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,形成正四面体结构的氢化物是甲烷或硅烷,形成三角锥型的氢化物是氨气,形成V型的氢化物是水或硫化氢,形成直线型结构的氢化物是乙炔、氟化氢或氯化氢,这几种元素的原子序数逐渐增大,所以P的氢化物是甲烷,Q的氢化物是氨气,X的氢化物是硅烷,Y的氢化物是硫化物,Z的氢化物是氯化氢,则P、Q、X、Y、Z分别是C、N、Si、S、Cl元素;
(1)Z为Cl元素,其基态原子电子排布式是1s22s22p63s23p5,价电子排布式为3s23p5,QZ3为NCl3,N原子形成3个σ键,孤对电子数为![]() =1,为三角锥形;
=1,为三角锥形;
(2)X与Z构成的分子是SiCl4,为正四面体结构,属于非极性分子;
(3)P和Y形成的化合物为CS2,结构式为S=C=S,含有2个σ键,2个π键,C形成2个σ键,没有孤对电子,为sp杂化;
(4)Y为硫元素,Z为氯元素,可以通过H2S与Cl2的反应证明氯元素的非金属性比硫元素强,相关的离子反应方程式为H2S+Cl2═2H++2Cl-+S↓;
(5)镁和氮气反应生成氮化镁,氮化镁与水反应生成两种碱,分别是氢氧化镁和氨气,所以该反应的化学方程式Mg3N2+6H2O═3Mg(OH)2+2NH3↑。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中正确的有儿项( )
①1L0.1mol/LK2Cr2O7溶液中Cr2O72-的数目小于0.1NA
②1molCl2做氧化剂时得到的电子数为2NA
③25℃时,1LpH=12的碳酸钠溶液中含有Na+的数目为0.02NA
④过氧化钠与水反应时,生成0.5molO2转移的电子数为2NA
⑤50mL18.4mol/L的浓硫酸与足量的铜微热后反应,生成SO2分子数小于0.46NA
⑥利用氰尿酸与次氯酸在一定pH下反应可制备三氯异氰尿酸(结构如图).若原料完全反应,得到1mol产物同时生成3NA个H2O

A.2 C.4 B.3 D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。

(1)气密性检验的操作过程是________________。
(2)为快速得到乙醇气体,可采取的方法是________________;若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是________________(填写编号);
a.取下小试管
b.移去酒精灯
c.将导管从乳胶管中取下
d.以上都可以
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验.
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
②经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是________________;关于M 中铁元素价态的判断正确的是________________(填写编号).
a.一定有+3价和+2价铁,无0价铁
b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,无+2价铁
d.一定有+3价,0价和+2价铁至少有一种
(4)若M的成份可表达为FexOy,用CO还原法定量测定其化学组成.称取ag M样品进行定量测定,实验装置和步骤如下:

①组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧….正确的操作顺序是________________(填写编号)
a.①⑤④③②⑥⑦⑧
b.①③⑤④②⑦⑥⑧
c.①⑤③④②⑥⑦⑧
d.①③⑤②④⑥⑦⑧
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FexOy中![]() =________________。
=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。

(1)写出BA3的电子式___________;
(2)B元素基态原子中能量最高的电子,其电子云在空间有________个取向,原子轨道呈_____形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() ,该同学所画的电子排布图违背了___________;
,该同学所画的电子排布图违背了___________;
(4)G位于_____族______区,该元素的核外电子排布式为___________;
(5)DE3中心原子的杂化方式为________,用价层电子对互斥理论推测其空间构型为___________;
(6)检验F元素的方法是___________,请用原子结构的知识解释产生此现象的原因___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课上,围绕硫的化合物性质进行如下探究,请根据要求回答以下问题。

(1)装置A中反应的化学方程式为________________________________。
(2)装置B用来探究SO2的漂白性,则应装的试剂是________,反应一段时间后,看到的现象是________________;若将Cl2通入B中也能看到同样的现象,则二者在反应原理上________(填“相同”或“不相同”)。
(3)装置C检验SO2具有______性(填“氧化”或“还原”)。装置C试管口棉花团应蘸有_____溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
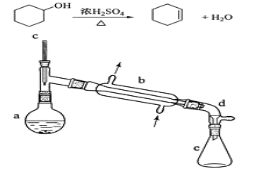
可能用到的有关数据如下:

合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置a的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是 。
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有 (填正确答案标号)。
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验所得到的环己烯产率是 。(保留两位有效数字)
(注:产率=实际产量/理论产量×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下:

(1)仪器A为________(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为________;
(2)完善步骤Ⅳ涉及的离子方程式:______C2O42-+ MnO4-+ H+= Mn2++ CO2↑+ ;该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面.
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl-影响
猜想2:配制Na2C2O4标液定容时________;
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl-影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液)________。
资料卡片:
①有机质可HNO3被氧化
②AgCl不与酸性KMnO4溶液反应
③Ag2C2O4可被酸性KMnO4溶液氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废渣、废水回收利用是重要研究课题。下面流程是生产食用香料正丁酸乙酯的工厂废水(含乙醇、正丁酸乙酯、正丁酸、乙醚和大量无机悬浮物)联合利用电子工业废料[含SiO2和Cu2(OH)2CO3]回收铜的工艺设计。回答下列问题:

(1)初沉加入的试剂是明矾,写出参与净水的离子的水解方程式:______________________。
(2)固体X的成分是__________,反应Ⅰ的化学反应方程式____________________________。
(3)试剂Y为__________,加快反应Ⅱ速率的措施有__________________(任写一条)。
(4)反应Ⅲ的离子方程式为________________________________________。
(5)硅胶在生活与生产中用途广泛,写出其中一种用途:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“关爱生命,注意安全”。惨痛的天津爆炸触目惊心,火灾之后依然火势绵延不绝的原因之一是易燃物中含有电石。工业上常用电石(主要成分为CaC2,杂质为CaS等)与水反应生产乙炔气。
(1)工业上合成CaC2主要采用氧热法。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464.1kJ·mol-1
C(s)+l/2O2(g)=CO(g) △H=-110.5kJ.mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO,为维持热平衡,每生产l molCaC2,转移电子的物质的量为_______。
(2)已知2000℃时,合成碳化钙的过程中还可能涉及到如下反应
CaO(s)+C(s) ![]() Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+2C(s) ![]() CaC2(s) K2 △H2=b KJ·mol-1
CaC2(s) K2 △H2=b KJ·mol-1
2CaO(s)+CaC2(s) ![]() 3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
则K1=_______ (用含K2、K3的代数式表示);c=_____(用含a、b的代数式表示)。
(3)利用电石产生乙炔气的过程中产生的H2S气体制取H2,既廉价又环保。

①利用硫化氢的热不稳定性制取氢气。在体积为2L的恒容密闭容器中,H2S起始物质的量为2mol,达到平衡后H2S的转化率![]() 随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
②电化学法制取氢气的原理如图2,请写出反应池中发生反应的离子方程式_____,惰性电极a上发生的电极反应式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com