
| A.②③ | B.②④⑤ | C.⑤⑥ | D.③④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 CH3COOH+OH-
CH3COOH+OH- CH3COOH+OH-
CH3COOH+OH-查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
| 1 |
| 6 |
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
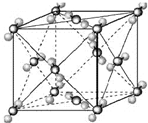 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目:高中化学 来源: 题型:
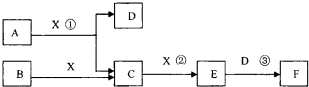


| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com