
+ 4 |
2- 3 |
2- 4 |
| ||
| 4.66g |
| 233g/mol |
| 3.94g |
| 197g/mol |


科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第8期 总第164期 人教课标版 题型:058
已知NH4++OH-![]() NH3↑+H2O.现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、Ba2+、CO32-、SO42-.现取三份200 mL溶液进行如下实验:①第一份中加入AgNO3溶液有沉淀产生;②第二份中加入足量NaOH溶液加热后,收集到气体0.05 mol;③第三份中加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g.
NH3↑+H2O.现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、Ba2+、CO32-、SO42-.现取三份200 mL溶液进行如下实验:①第一份中加入AgNO3溶液有沉淀产生;②第二份中加入足量NaOH溶液加热后,收集到气体0.05 mol;③第三份中加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g.
(1)原溶液中一定存在的离子是________.
(2)原溶液中一定不存在的离子是________.
(3)请写出原溶液中一定存在的阳离子的物质的量浓度:________.
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第6期 总第162期 人教课标版 题型:058
现有一混合物的水溶液,只可能含有以下离子中的若干种:
K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-.现取三份溶液各100 mL进行如下实验:①第一份加入AgNO3溶液有沉淀产生;②第二份加足量NaOH溶液加热后,收集到碱性气体0.04 mol;③第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g.根据上述实验,回答下列问题:(1)一定不存在的离子是________,不能确定是否存在的离子是________.
(2)试确定溶液中肯定存在的阴离子及其浓度(可不填满):
离子符号________,浓度________;
离子符号________,浓度________;
离子符号________,浓度________.
(3)K+________(填“一定”或“一定不”)存在,理由是________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省高三第二次质量检测化学试卷(解析版) 题型:填空题
(11分)下图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
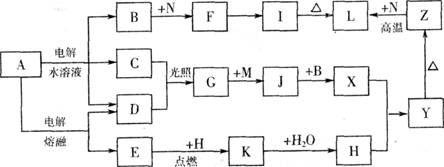
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。(填设备名称)
(2) 写出A的水溶液电解的离子方程式 。
(3) 写出K与CO2反应的化学方程式 。
(4) Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,写出该反应的离子方程式 。
(5) 一定量的Z与N的混合物分为两等分,一份直接与足量氢氧化钠溶液产生气体为amol,另一份高温下充分反应(不考虑固体与氧气的反应)后的固体混合物与足量盐酸产生气体为bmol,现有a:b=9:7,则混合物中Z与N的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
⑴第一份加入几滴AgNO3溶液后有沉淀产生;
⑵第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
⑶在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
⑷第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g。
下列说法不正确的是
A、步骤⑶后可以确定CO32-一定不存在 B、忽略步骤⑴对实验结论并无影响
C、不能确定原溶液是否含有K+和Cl-
D、若把步骤⑵产生的气体通入步骤⑴的滤液中,又可产生0.78g沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com