
下列物质的熔点或液化温度由高到低顺序正确的是
A.HBr>HCl>HF B.锂>钾>钠
C.NaF>NaCl>NaBr D.金刚石>晶体硅>碳化硅
科目:高中化学 来源: 题型:
在一定温度下,固定体积为2 L密闭容器中,发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,n(SO2)随时间的变化如表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是( )
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4 min内该反应的平均速率为0.005 mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y是核电荷数不大于18的元素。X原子的最外层电子数为a,次外层电子数为a+2;Y原子的最外层电子数为b-5, 次外层电子数为b。判断X、Y元素形成的化合物组成是( )
A.XY2 B.Y2X3 C.Y4X D.YX3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
 ①S8 分子中 S原子采用的轨道杂化方式sp3
①S8 分子中 S原子采用的轨道杂化方式sp3
②C2H4分子中只有以s轨道与sp2杂化轨道“头碰头”方式重叠而成的σ键
③SnBr2分子中Sn—Br的键角<120°
④H3O+中H-O-H键角比H2O中H-O-H键角大
A.①② B.③④ C.①②③ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为________;
 1 mol B2A4分子中含__________mol σ键。
1 mol B2A4分子中含__________mol σ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为_________,乙为___________;高温时,甲易转化为乙的原因为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2SO2(g)+O2(g)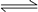 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某可逆反应在密闭容器中进行:
A(g)+2B(g) 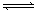 3C(g)+D(s)(放热反应),右图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是
3C(g)+D(s)(放热反应),右图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是
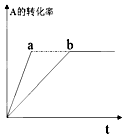
A.增大A的浓度 B.增大容器的容积
C.加入催化剂 D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
图182是三种稀酸对FeCr合金随Cr的含量变化的腐蚀性实验结果,下列有关说法正确的是( )

图182
A.稀硝酸对FeCr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)===Fe(NO3)3+3NO2↑+3H2O
C.Cr的含量大于13%时,因为三种酸中硫酸电离的氢离子的浓度最大,所以其对FeCr合金的腐蚀性最强
D.随着Cr的含量的增加,稀硝酸对FeCr合金的腐蚀性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com