
【题目】某同学用下列装置制备并检验Cl2的性质。
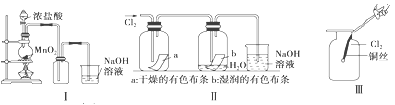
(1)Ⅰ图圆底烧瓶中反应的化学方程式是
(2)Ⅱ图中褪色的是 (填a或b),烧杯中反应的离子方程式是
(3)将Cu丝换成Fe丝,做Ⅲ实验,结果也能点燃,你认为Fe丝也可点燃的最确切的理由是 。
A.Fe与Cu都是金属元素 B.Fe的熔点比Cu高
C.Fe的密度比Cu小 D.Fe的金属性比Cu强
(4)将Ⅳ装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成,量筒内液面上升。油状液滴的成分可能是(写分子式) ,量筒内液面上升的主要原因是_________。
【答案】
(1)MnO 2 +4HCl(浓)![]() MnCl 2 +Cl 2 ↑+2H 2O
MnCl 2 +Cl 2 ↑+2H 2O
(2)b ; Cl 2 +2OH - ==Cl - +ClO - +H 2O;
(3)D;
(4)CH2Cl2、CHCl3、CCl4;生成的HCl气体溶解于饱和食盐水,量筒内的气压在减小。
【解析】
试题分析:(1)Ⅰ图圆底烧瓶中浓盐酸与MnO2混合加热,发生氧化还原反应产生氯气,反应的化学方程式是MnO 2 +4HCl(浓)![]() MnCl 2 +Cl 2 ↑+2H 2O;(2)干燥的氯气没有漂白性,氯气与水反应产生的HClO具有漂白性,所以Ⅱ图中褪色的是b,在烧杯中Cl2与NaOH反应产生NaCl、NaClO和水,反应的离子方程式是Cl 2+2OH - ==Cl -+ClO -+H 2O;(3)将铜丝换成铁丝,做Ⅲ实验,结果也能点燃,因为Fe的金属性比Cu强,能与氯气反应生成氯化铁,选项D正确;(4)将盛有CH4和Cl2的混合气体的Ⅳ装置放置在光亮的地方(日光没有直接照射),这时会发生取代反应产生CH3Cl、CH2Cl2、CHCl、CCl4及HCl,HCl容易溶于水,而反应产生的有机物CH2Cl2、CHCl、CCl4都是难溶于水的液体物质,所以一会儿后,观察到量筒壁上有油状液滴生成,量筒内液面上升。油状液滴的成分可能是CH2Cl2、CHCl、CCl4,量筒内液面上升的主要原因是生成的HCl气体溶解于饱和食盐水,使量筒中的气体压强减小,在外界大气压强的作用下,水进入量筒内。
MnCl 2 +Cl 2 ↑+2H 2O;(2)干燥的氯气没有漂白性,氯气与水反应产生的HClO具有漂白性,所以Ⅱ图中褪色的是b,在烧杯中Cl2与NaOH反应产生NaCl、NaClO和水,反应的离子方程式是Cl 2+2OH - ==Cl -+ClO -+H 2O;(3)将铜丝换成铁丝,做Ⅲ实验,结果也能点燃,因为Fe的金属性比Cu强,能与氯气反应生成氯化铁,选项D正确;(4)将盛有CH4和Cl2的混合气体的Ⅳ装置放置在光亮的地方(日光没有直接照射),这时会发生取代反应产生CH3Cl、CH2Cl2、CHCl、CCl4及HCl,HCl容易溶于水,而反应产生的有机物CH2Cl2、CHCl、CCl4都是难溶于水的液体物质,所以一会儿后,观察到量筒壁上有油状液滴生成,量筒内液面上升。油状液滴的成分可能是CH2Cl2、CHCl、CCl4,量筒内液面上升的主要原因是生成的HCl气体溶解于饱和食盐水,使量筒中的气体压强减小,在外界大气压强的作用下,水进入量筒内。


科目:高中化学 来源: 题型:
【题目】化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得。A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应:

(1)试写出化合物的结构简式:A_____________,E_____________,F_____________。
(2)化学方程式:A→B:______________________________________,
(3)四个反应中,不属于酯化反应的是:A→_________(填化合物对应的字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期原子序数依次递增的五种元素A、B、C、D、E。 A、D元素基态原子中成对电子数是未成对电子数的3倍,且D元素基态原子中有6个未成对电子;B的基态原子核外只有7个原子轨道填充了电子,B、C元素基态原子的3p能级上均有1个未成对电子;E元素排在周期表的15列。
(1)B元素基态原子核外电子有_______种运动状态,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_______、电子数为_____。
(2)C、E两元素可以形成化合物EC3,此化合物的VSEPR模型为_______,是_______分子(填“极性”、“非极性”)。
(3)写出D基态原子的外围电子排布图____________。
(4)B、C两元素也可以形成共价化合物BC3,但BC3经常以二聚(B2C6)的形式存在,二聚分子具有配位键,分子中原子间成键的关系如下图所示.请将图中,你认为是配位键的斜线上加上箭头。
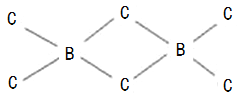
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色混合气体可能由H2、O2、NH3、N2、CO2、HCl和He中的两种或多种组成。常温下取此气体200mL进行实验,实验的过程和结果如下(上述气体的体积都是折算成相同条件下的体积)。下列说法错误是

A.原混合气体中有5ml O2
B.原混合气体中肯定存在NH3,肯定不存在HCl
C.原混合气体中CO2的体积分数为40%
D.可能存在N2或He,它们在原混合气体中的体积分数不可能超过5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质架构和性质的重要工具。请参照元素①—⑦在周期表中的位置,回答下列问题:

(1)元素⑦在元素周期表的位置为____________。
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式 。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为 。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:
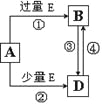
①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用苯和浓硝酸、浓硫酸按照如图装置制取硝基苯,回答下列问题:

(1)在配制混合酸时应将___________加入到___________中去;
(2)被水浴加热的试管口处都要带一长导管,其作用___________。
(3)该反应的化学方程式是___________;反应类型:___________。
(4)此装置存在几处错误,请修改(可不必填满).①______;②______;
③________。
(5)请从下列操作:①蒸馏;②水洗;③用干燥剂干燥;
④用10%NaOH溶液洗;⑤水洗,选择合适操作,进行分离混酸后的粗产品精制:分液________分液________分液________过滤________。(用序号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Ⅰ.按己知的原子结构规律,82号元素X应是第_________周期_________族元素,它的最高正价氧化物的化学式为_________。
Ⅱ.下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解。用序号填空:
(1)未破坏化学键的是_____________。
(2)仅离子键被破坏的是_____________。
(3)仅共价键被破坏的是_____________。
Ⅲ.有下列各组物质:①石墨和足球烯C60;②126C和136C;③CH3—CH2—CH2—CH3和CH3—CH(CH3)CH3;④漂白粉和漂白液主要成分;⑤正丁烷和异庚烷;⑥乙烯和聚乙烯;⑦![]() 和
和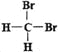 ;⑧丙烷和环丙烷。用序号填空:
;⑧丙烷和环丙烷。用序号填空:
(1)__________组两者互为同位素。(2)__________组两者互为同素异形体。
(3)__________组两者属于同系物。(4)__________组两者互为同分异构体。
(5)__________组两者是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
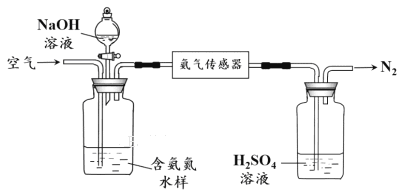
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
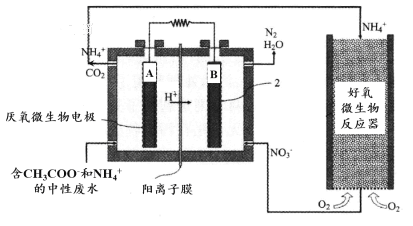
① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4===FeSO4+H2↑的能量变化趋势,如图所示:
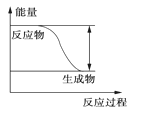
(1)该反应为________反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_____(填字母)。
A.改铁片为铁粉 B.增大压强
C.升高温度 D.改稀硫酸为98%的浓硫酸
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”)。铜片上产生的现象为________________;该极上发生的电极反应为______________;外电路中电子由 _______极向_______极移动。(填“正”或“负”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com