
【题目】加热条件下,将24.0gCuO和Fe2O3的混合物与足量的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40.0g。下列有关叙述中不正确的是( )
A. 原混合物中CuO和Fe2O3的物质的量的比为1:1
B. 参加反应的CO的质量为11.2g
C. 原混合物中Fe元素的质量为5.6g
D. 原混合物中CuO的质量分数约为33.3%
【答案】C
【解析】试题分析:反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40g为碳酸钙质量,碳酸钙的物质的量为![]() =0.4mol,根据碳原子守恒,所以反应后所得CO2的物质的量为为0.04mol。一个CO获得1个氧原子生成CO2,根据氧原子守恒,可知24gCuO、Fe2O3的混合物中氧原子的物质的量为0.4mol。
=0.4mol,根据碳原子守恒,所以反应后所得CO2的物质的量为为0.04mol。一个CO获得1个氧原子生成CO2,根据氧原子守恒,可知24gCuO、Fe2O3的混合物中氧原子的物质的量为0.4mol。
令CuO、Fe2O3的物质的量分别为x、y,则①x+3y=0.4mol②x×80g/mol+y×160g/mol=24g解得:x=0.1mol,y=0.1mol。A.由上述计算可知,原混合物中CuO与Fe2O3物质的量比为0.1mol:0.1mol=1:1,故A正确;B.实验过程中参加反应的CO质量为0.4mol×28g/mol=11.2g,故B正确;C.根据上述分析可知Fe2O3的物质的量为0.1mol,则铁元素的物质的量为0.2mol,所以原混合物中Fe元素的质量为11.2g,故C错误;D.由上述计算可知,原混合物中CuO与Fe2O3物质的量比为0.1mol:0.1mol=1:1,所以原混合物中CuO与Fe2O3的质量比为80:160=1:2,即原混合物中CuO的质量分数约为33.3%,故D正确。故选C。


科目:高中化学 来源: 题型:
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
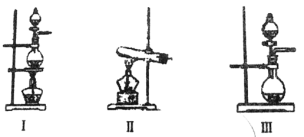
① | 制备氧气 | H2O2→O2 | __________________ |
② | 制备二氧化硫 | Na2SO3→SO2 | __________________ |
③ | 制备氯气 | HCl→Cl2 | __________________ |
(1)上述气体中从制备过程看,必须选择合适的氧化剂才能实现的是__________________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是__________________;
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。
(3)某学习小组设计了如图实验,将氯气依次通过下列装置以验证氯气的性质:

①通入氯气后,A中的现象是__________________,整套实验装置存在的明显缺陷是__________________;
②C装置中发生反应的离子方程式为__________________。
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化。具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化。你认为__________________ (填“是”或“否”)合理?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题:
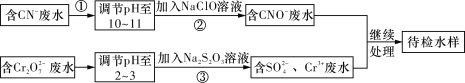
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:_________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每消耗0.4 mol Cr2O72-转移________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是:___________________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物不能由CH2=CH2通过加成反应制取的是
A.CH3CH2Cl B.CH2Cl—CH2Cl C.CH3—CH3OH D.CH3—COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应温度 |
A | 0.1mol Mg | 6mol/L硝酸 | 10mL | 60℃ |
B | 0.1mol Mg | 3mol/L盐酸 | 10mL | 30℃ |
C | 0.1mol Fe | 3mol/L盐酸 | 10mL | 60℃ |
D | 0.1mol Mg | 3mol/L盐酸 | 10mL | 60℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通式为CnH2n-2的一种气态烃完全燃烧后生成的CO2和H2O物质的量之比为4∶3。这种烃的链状同分异构体有 ( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
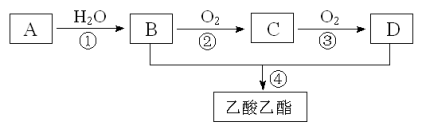
回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型:
① ,② , 。
(4)写出下列反应的化学方程式:
① ;
② ;
④ 。
(5)已知46gB完全燃烧生成液态水放出热量为1366.8kJ, 写出该反应的热化学方程式______________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合成重要的有机化合物路线如下图所示。请回答下列问题。
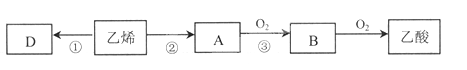
(1)乙烯的结构简式___________。
(2)A物质所含官能团的名称是__________________。
(3)反应②的反应类型是_______________________。
(4)反应③的化学方程式是___________________________________。
(5)以乙烯为原料可合成有机高分子化合物D,反应①的化学方程式是
____________________________________________________________。
(6)下列物质中,可以通过乙烯加成反应得到的是_____(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com