
����Ŀ��ij��ҵ��ˮ�к���CN����Cr2O72�������ӣ��辭��ˮ������������ŷţ���ˮ�����������������̽��д������ش��������⣺
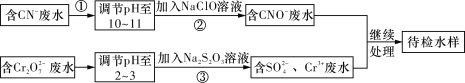
��1���������У�CN����ClO������ΪCNO�������ӷ���ʽΪ��_________________��
��2���������ķ�ӦΪS2O32����Cr2O72����H���D��SO42����Cr3����H2O(δ��ƽ)����ÿ����0.4 mol Cr2O72��ת��________mol e����
��3����Cr3����ˮ���Լ�����ʯ�ҽ�һ��������Ŀ����_________________��
��4����25 ���£���a mol��L��1��NaCN��Һ��0.01 mol��L��1������������ϣ���Ӧ������ҺpH��7����a__________0.01(������������������������)���ú�a�Ĵ���ʽ��ʾHCN�ĵ��볣��Ka��______________________��
��5��ȡ��ҵ��ˮˮ�����Թ��У�����NaOH��Һ�۲쵽����ɫ�������ɣ������������ٲ�����ɫ����Ϊֹ��������Һ�м�������Na2S��Һ����ɫ����ת���ɺ�ɫ�������ù����з�Ӧ�����ӷ����ǣ�___________________��___________________��
���𰸡���1��CN����ClO��===CNO����Cl������2��2.4
��3�����ڷ�ˮpH��ʹ��ת����Cr(OH)3������ȥ(���������𰸾�����)
��4������(100a��1)��10��7 mol��L��1��
��5��Cu2����2OH��===Cu(OH)2����Cu(OH)2(s)��S2��(aq)===CuS(s)��2OH��(aq)(��ע��״̬Ҳ��)
��������
��������������̿�֪��CN-��ˮ������ҺpH����NaClO��Һ������CN-���ӷ�Ӧ����CNO-�ķ�ˮ����Cr2O72-�ķ�ˮ������ҺpH����Na2S2O3����������ԭ��Ӧ�õ�����������ӵķ�ˮ�������ķ�ˮ���������õ�����ˮ����
��1�����������£�CN-������NaClO����������ԭ��Ӧ����CNO-��Cl-���ӣ����ӷ�ӦΪ��CN-+ClO-�TCNO-+Cl-���ʴ�Ϊ��CN-+ClO-�TCNO-+Cl-��
��2������0.4 mol Cr2O72-��ת��ΪCr3+����Ԫ�ػ��ϼ۽���3�ۣ�0.4molCr2O72-���õ���0.4��(2��3)mol=2.4mol���ʴ�Ϊ��2.4��
��3����Cr3+��ˮ���Լ�����ʯ�ҽ�һ��������Ŀ���ǵ��ڷ�ˮpH��ʹ��ת����Cr(OH)3������ȥ���ʴ�Ϊ�����ڷ�ˮpH��ʹ��ת����Cr(OH)3������ȥ��
��4�����ڷ�Ӧ������ҺpH=7����a=0.01ʱ��ǡ�÷�Ӧ���������軯����Һ����Һ��ʾ���ԣ����軯��Ӧ�ö�Щ����a��0.01�� �ɵ���غ�c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-)��pH=7����֪c(H+)=c(OH-)=10-7 molL-1��c(CN-)=c(Na+)-c(Cl-)=![]() mol/L-
mol/L-![]() mol/L���ٸ��������غ㣺c(CN-)+c(HCN)=c(Na+)=
mol/L���ٸ��������غ㣺c(CN-)+c(HCN)=c(Na+)=![]() mol/L��Ka��
mol/L��Ka��![]() =
= =(100a-1)��10-7 molL-1���ʴ�Ϊ������(100a-1)��10-7 molL-1��
=(100a-1)��10-7 molL-1���ʴ�Ϊ������(100a-1)��10-7 molL-1��
��5����ɫ����ΪCu(OH)2��CuS(s)��Cu(OH)2(s)�����ܣ������˳�����ת�����漰�����ӷ�Ӧ����ʽΪCu2++2OH-�TCu(OH)2����Cu(OH)2(s)+S2-(aq)�TCuS(s)+2OH-(aq)���ʴ�Ϊ��Cu2++2OH-�TCu(OH)2����Cu(OH)2(s)+S2-(aq)�TCuS(s)+2OH-(aq)��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����Դ������������������Դ���õ�������ء�����˵����ȷ����
A�������ǷŴ��ط�����Դ��Ӧ�����������
B��ʵ�ֻ�ʯȼ��������ã������迪������Դ
C��Ϊ���ũ����IJ�����������Ӧ����ʹ�û��ʺ�ũҩ
D����������ֲ�����������ع��͡����������������Ϊʳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ�������л�������A��C6H6O������Ҫ�Ļ���ԭ�ϣ��ڹ�ҵ���ܺϳ����������ռ�BAD���������ಡҩ����м���F���ϳ�·�����£�

��֪��BAD�Ľṹ��ʽΪ��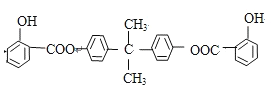
F�Ľṹ��ʽΪ��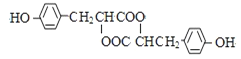
�Իش�
��1��H�к��еĹ����������� ��
��2��д��X�Ľṹ��ʽ ���Ʋ�B�ĺ˴Ź�����������ʾ�� �ֲ�ͬ��ѧ��������ԭ�ӣ�
��3��д����Ӧ���� C��D ��E��F ��
��4��1mol C��Ũ��ˮ��Ӧ������������ molBr2��
��5��C��D�Ĺ����п�������һ�ֲ���C1����д��C1�ڼ���������������ϡNaOHˮ��Һ
��Ӧ�Ļ�ѧ����ʽ�� ��
��6��W��ͬ���칹�����������ʣ���FeCl3��Ӧ����Һ����ɫ���ܷ���������Ӧ�����ͬ
���칹�干�� �֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫���һ��Ũ�ȵ�CuSO4��Һʱ��ͨ��һ��ʱ��������õ���Һ�м���0.1 mol Cu2(OH)2CO3��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH(�����Ƕ�����̼���ܽ�)�����������ת�Ƶĵ��ӵ����ʵ���Ϊ�� ��
A. 0.4 mol B. 0.5 mol
C. 0.6 mol D. 0.8 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ƴ���������818��Ĵ��ŷ���������һ����������������ʯ�裬ȡ��һ����̿������֭��������ɫ��ѩ��ν֮��ʯ�����ݴ��Ʋ⣬������������ʯ�裬����Ҫԭ�ϵĻ�ѧ�ɷ�Ϊ
A��CuSO4 B��FeSO4�q7H2O C��KAl��SO4��2�q7H2O D��Fe2��SO4��3�q7H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ͨ��Ҫ�Ȱ����ȶ�������������Ӧ��
��P4(����,s)+5O2(g)=2P2O5(s) ��H1
��4P(����,s)+5O2(g)=2P2O5(s) ��H2
����H1����H2�Ĺ�ϵ��
A����H1=��H2 B����H1����H2 C����H1����H2 D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.6molп�۸��������ᷴӦ����һ���¶��£�Ϊ�ӿ췴Ӧ���ʵ��ֲ�Ӱ����������������������Ӧ������м���������
A��ͭ�� B������п��Һ C���Ȼ�ͭ���� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£���24.0gCuO��Fe2O3�Ļ������������CO��ȫ��Ӧ��������Ӧ�������ȫ��ͨ�뵽�����ij���ʯ��ˮ�У��õ���ɫ����40.0g�������й������в���ȷ���ǣ� ��
A. ԭ�������CuO��Fe2O3�����ʵ����ı�Ϊ1:1
B. �μӷ�Ӧ��CO������Ϊ11.2g
C. ԭ�������FeԪ�ص�����Ϊ5.6g
D. ԭ�������CuO����������ԼΪ33.3%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧԭ�����Ϲ�ҵұ������þ����
A��2Na+MgCl2=2NaCl+Mg
B��MgCl2(�ۻ�)![]() Mg+Cl2
Mg+Cl2
C��2MgO![]() 2Mg+O2
2Mg+O2
D��MgO+C![]() MgO+C
MgO+C
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com