
【题目】某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )
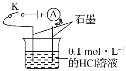
A.闭合开关K,电流表指针发生偏转,证明HCl溶液是电解质
B.闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流表指针不发生变化
C.闭合开关K,向溶液中加入CaCO3固体,电流表示数不变
D.选取相同质量分数的硫酸替换HCl溶液,电流表的示数相同
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
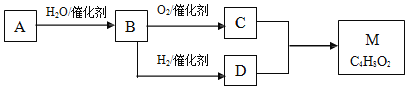
【题目】烃A与等物质的量的H2O反应生成B,B的一种同系物的溶液可以浸制标本。M是有香味、不易溶于水的油状液体。有关物质的转化关系如下:
请回答:
(1)写出A的结构简式:______
(2)写出C的官能团的名:______
(3)写出M与NaOH溶液在加热条件下反应的化学反应方程式:______
(4)下列说法不正确的是______
A.烃A在一定条件下可与氯化氢发生反应,再通过加聚反应可得到聚氯乙烯
B.有机物C的溶液可以除去水垢
C.有机物B能与银氨溶液在酒精灯加热的条件下反应产生光亮的银镜
D.有机物C和D发生加成反应生成M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示。原溶液中Cl-与SO42-的物质的量之比为( )

A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面已被氧化成氧化钠的钠块(质量为5.4 g)投入足量的水中,产生标准状态下的H2 1.12 L,则原来被氧化的钠的质量为
A.5.3gB.4.6 gC.3.1 gD.2.3 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
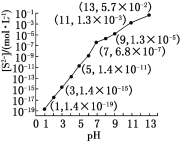
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]
高锰酸钾(![]() )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
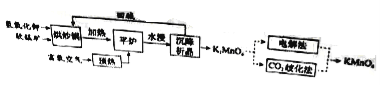
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验溶液中是否含有某种离子,下列操作方法正确的是 ( )
A. 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32一
B. 某溶液加入氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定含有NH4+
C. 某溶液滴入BaCl2溶液,再滴加稀盐酸,产生白色沉淀,则一定含有SO42一
D. 某溶液加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则一定含有Ba2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com