
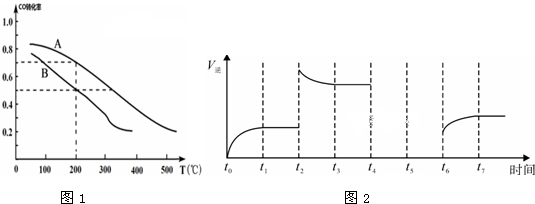
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
| [CH3OCH3][H2O] |
| [CH3OH] |
| [CH3OCH3][H2O] |
| [CH3OH] |
| 0.5a |
| 0.5a+a+0.5a |
 ,
, .
.


科目:高中化学 来源: 题型:
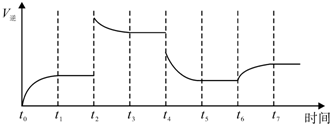
| A、v(A)=0.15 mol/(L?min ) |
| B、v(B)=0.5 mol/(L?min) |
| C、v(C)=0.4 mol/(L?min) |
| D、v(D)=0.02 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 一定条件 |
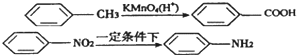
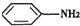 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)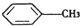 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、612C和613C |
| B、O2和O3 |
| C、(CH3)2CHCH2CH3和C(CH3)4 |
| D、H2C(CH3)2和CH3CH2 CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com