
【题目】下图中的每个方格表示有关的一种反应物或生成物,M分解生成A、B、C的物质的量之比为l:l:1,其中A和C为无色气体。
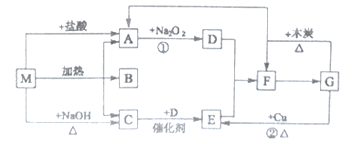
(1)物质M是__________(写名称),C是_____________(写化学式);
(2)M与盐酸反应生成A的离子方程式:_______________________________;
(3)反应②的离子方程式:_________________________________________________;
(4)G与木炭反应的化学方程式:_________________________________________;
(5)F生成G的化学方程式:______________________________________________。
【答案】 碳酸氢铵 NH3 H++HCO3-==CO2↑+H2O 3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 3NO2+H2O==2HNO3+NO
CO2↑+4NO2↑+2H2O 3NO2+H2O==2HNO3+NO
【解析】本题考查无机推断,M为化合物,与NaOH反应生成C,C为气体,则C为NH3,即M为铵盐,C与D在催化剂的作用下生成E,应为氨气的催化氧化,4NH3+5O2 ![]() 4NO+6H2O,即D为O2,E为NO,NO与氧气反应生成NO2,即F为NO2,G能与木炭、铜发生反应,且G是由F生成,则G为HNO3,木炭与硝酸反应生成CO2、NO2、H2O,即A为CO2,因为M受热分解生成A、B、C物质的量之比为1:1:1,则M为NH4HCO3,(1)根据上述分析,M为碳酸氢铵,C为NH3;(2)NH4HCO3与盐酸的反应:HCO3-+H+=CO2↑+H2O;(3)反应②是铜与稀硝酸的反应,其离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;(4)木炭与硝酸反应:C+4HNO3(浓)
4NO+6H2O,即D为O2,E为NO,NO与氧气反应生成NO2,即F为NO2,G能与木炭、铜发生反应,且G是由F生成,则G为HNO3,木炭与硝酸反应生成CO2、NO2、H2O,即A为CO2,因为M受热分解生成A、B、C物质的量之比为1:1:1,则M为NH4HCO3,(1)根据上述分析,M为碳酸氢铵,C为NH3;(2)NH4HCO3与盐酸的反应:HCO3-+H+=CO2↑+H2O;(3)反应②是铜与稀硝酸的反应,其离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;(4)木炭与硝酸反应:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;(5)NO2生成硝酸,是NO2与水的反应,反应方程式为:3NO2+H2O==2HNO3+NO。
CO2↑+4NO2↑+2H2O;(5)NO2生成硝酸,是NO2与水的反应,反应方程式为:3NO2+H2O==2HNO3+NO。


科目:高中化学 来源: 题型:
【题目】可逆反应:aA(g)+bB(g)cC(g)+dD(g);根据图1,2回答: 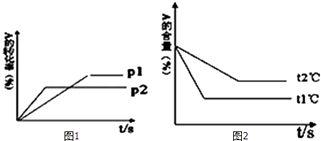
(1)压强 P1比P2(填“大”或“小”);
(2)(a+b)比(c+d)(填“大”或“小”);
(3)温度t1℃比t2℃(填“高”或“低”);
(4)正反应为反应(填“吸热”或“放热”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列蓝瓶子实验,振荡周期最短的是( )
水 | 葡萄糖 | 0.1%亚甲基蓝 | NaOH溶液 | 温度 | |
A | 50 mL | 1.5 g | 8滴 | 2 mL | 40 ℃ |
B | 50 mL | 1.5 g | 10滴 | 2 mL | 40 ℃ |
C | 50 mL | 1.5 g | 8滴 | 2 mL | 25 ℃ |
D | 50 mL | 1.5 g | 10滴 | 2 mL | 25 ℃ |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是摘取学生实验报告单中的语句,其中说法正确的是( )
A.日常生活中不能用粥汤检验碘盐中是否含有KIO3
B.将铁屑、浓溴水、苯混合可制得溴苯
C.用蒸馏方法除去乙醇中的水
D.洗涤沉淀时,应用玻璃棒轻轻搅拌,使得沉淀表面上的杂质溶于水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶混有少量NaCl杂质的NaOH固体试剂,为准确测其纯度,采用盐酸滴定法进行测定.
①称取Wg NaOH固体试剂配制成100.00mL水溶液备用;
②将浓度为 c mol/L的标准盐酸装在用标准盐酸润洗过的25.00mL酸式滴定管中,调节液面位置在零刻度以下,并记下刻度;
③取V1mL NaOH待测溶液置于洁净的锥形瓶中,加入2~3滴甲基橙指示剂充分振荡,然后用浓度为c mol/L的标准盐酸滴定,重复测定3次,平均用去盐酸V2mL.
试回答:
(1)配制标准盐酸溶液时,必须使用的最主要玻璃仪器是 .
(2)滴定时,滴定过程中两眼应该注视 . 滴定终点时溶液颜色由色突变为色.在盛放待测溶液的锥形瓶下方放一张白纸的作用是 .
(3)下列操作会使实验测得结果偏大的是(填选项的序号);
A.用湿润的pH试纸测定某NaOH溶液的pH
B.中和滴定实验中用蒸馏水洗净的锥形瓶直接装待测液
C.若滴定前酸式滴定管尖嘴气泡未排出,滴定结束后气泡消失
D.装标准盐酸的酸式滴定管没有进行润洗
E.读数时,若滴定前仰视,滴定后俯视
(4)固体试剂NaOH的质量分数的表达式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述中正确的是( )
A.向溴水和碘水中分别加入少量CCl4,振荡后静置,下层的颜色都比上层深
B.用过量的NaOH溶液除去FeCl2溶液中的FeCl3
C.用托盘天平准确称取0.400 0 g食盐,配成500 mL浓度为0.020 0 mol·L-1的食盐水
D.某气体能使品红溶液褪色,则该气体一定是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应.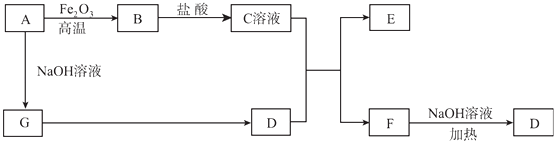
请回答下列问题:
(1)写出F的电子式:;
(2)①C溶液与D的水溶液反应的离子方程式为;②F溶液与NaOH溶液共热反应的化学方程式为;
(3)①请用离子方程式解释C溶液为何显酸性;②F溶液中离子浓度由大到小的顺序为;
(4)将5.4 g A投入到200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是(填代号);
A.HNO3溶液
B.H2SO4溶液
C.NaOH溶液
D.HCl溶液
(5)将1mol N2和3mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得D的物质的量浓度为a mol/L.在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5mol G达到平衡后,D的物质的量浓度(填“大于”“小于”或“等于”)a/2mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,将充满NO2的试管倒扣到盛水的水槽中,一段时间后,试管内气体的体积是试管体积的________________,假设试管内溶质不扩散,则试管内溶液中溶质的物质的量浓度为___________________。
(2)某铁的“氧化物”样品,用5mol/L的盐酸100mL恰好完全溶解,所得溶液还能吸收标准状况下1.12L氯气,使其中Fe2+恰好全部转化为Fe3+,发生反应的离子方程式为_________,该样品中Fe和O的个数比为_______________。
(3)向盛有10mL1mol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:(已知NH4++OH-=NH3·H2O)
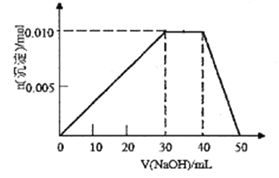
①写出滴加NaOH溶液40~50mL时反应的离子方程式:__________________。
②若10mL1mol/LNH4Al(SO4)2溶液中改加20mL1.15mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示,则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
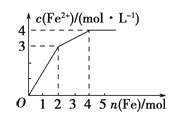
A.3∶1 B.1∶2 C.2∶1 D.1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com