
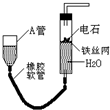
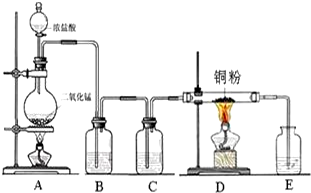
 如图的实验装置可用于实验室中制取乙炔及成份检验.
如图的实验装置可用于实验室中制取乙炔及成份检验.分析 (1)通过图中A管,可以控制反应的开始和停止;实验室通过电石与水的反应制取乙炔;
(2)乙炔能使酸性高锰酸钾溶液褪色,发生氧化反应;
(3)乙炔能使溴的四氯化碳溶液褪色发生加成反应;
(4)可燃性气体在点燃前必须检验其纯度,以免发生爆炸.因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟;
(5)能与溴发生反应的有苯酚、不饱和烃等,生成的乙炔含有硫化氢,可与溴发生氧化还原反应.
解答 解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O=Ca(OH)2+C2H2↑,
故答案为:调节水面高度以控制反应的发生和停止;CaC2+2H2O=Ca(OH)2+C2H2↑;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,故答案为:KMnO4溶液褪色;氧化;
(3)乙炔能够和溴水发生加成反应,可使溶液褪色,方程式为C2H2+2Br2=CHBr2CHBr2,故答案为:溴的四氯化碳溶液褪色;加成;
(4)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸.因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟,
故答案为:检查乙炔的纯度;火焰明亮并伴有浓烈的黑烟;
(5)生成的乙炔中往往混有硫化氢等气体,可与溴发生氧化还原反应而使溶液褪色,则A、C正确,BD错误,故答案为:AC.
点评 本题考查乙炔的实验室制法及其性质,侧重基础知识的考查,有利于培养学生的分析能力和实验能力,注意相关基础知识的积累,题目难度不大.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
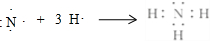
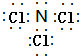
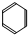 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
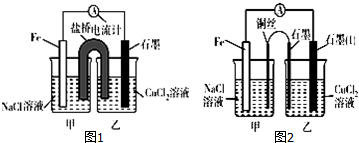
 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 单质与氢气化合的难易程度:Z>L | |
| B. | Y的氧化物对应的水化物不能溶于过量的氨水 | |
| C. | Z单质在氧气中燃烧生成ZO3 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
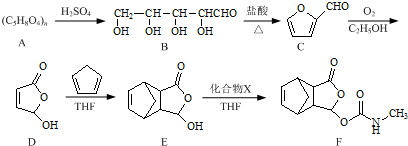
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
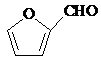 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$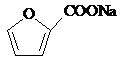 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.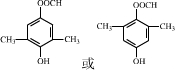 .
.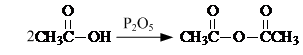 .
.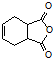 是合成抗病毒药阿昔洛韦的中间体,它可以用
是合成抗病毒药阿昔洛韦的中间体,它可以用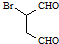 经氧化、消去、成酐一系列反应后再和原料M合成.
经氧化、消去、成酐一系列反应后再和原料M合成.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com