
【题目】下列有关电解质溶液的说法正确的是
A. 在蒸馏水中加入NH4NO3固体,Kw不变
B. 加水稀释FeCl3溶液,c(Fe3+)/ c(Cl-)的值减小
C. 加热蒸干并灼烧Al(NO3)3溶液得到Al(OH)3固体
D. 浓度均为0.1 mol·L-1的Na2CO3和NaHCO3的混合溶液中:3c(Na+)=2[c(CO32- )+c(HCO3-)+ c(H2CO3)]
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(![]() )可用于照相业作定影剂。工业上可用反应:
)可用于照相业作定影剂。工业上可用反应:
![]() 制得。实验室模拟该工业过程制备硫代硫酸钠溶液(装置如图)。
制得。实验室模拟该工业过程制备硫代硫酸钠溶液(装置如图)。
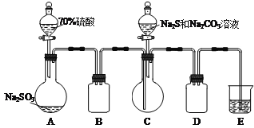
(1)装置A中反应的化学方程式___。
(2)装置B和D的作用是___。
(3)E中的试剂是___。
(4)反应一段时间后,装置C中得到产品是![]() ,其中还含有少量的
,其中还含有少量的![]() 。为测定装置C溶液中
。为测定装置C溶液中![]() 与
与![]() 的物质的量浓度之比,现进行如下实验:
的物质的量浓度之比,现进行如下实验:
步骤Ⅰ:取![]() 装置C烧瓶内的溶液置于锥形瓶中,加入足量的
装置C烧瓶内的溶液置于锥形瓶中,加入足量的![]() 溶液后再加入足量
溶液后再加入足量![]() 溶液,充分反应后,过滤,洗涤,干燥,得到固体的质量为
溶液,充分反应后,过滤,洗涤,干燥,得到固体的质量为![]() 。
。
步骤Ⅱ:另取![]() 装置C烧瓶内的溶液置于锥形瓶中,以淀粉作指示剂,用
装置C烧瓶内的溶液置于锥形瓶中,以淀粉作指示剂,用![]() 碘标准溶液滴定,滴定至终点消耗碘的标准溶液体积为
碘标准溶液滴定,滴定至终点消耗碘的标准溶液体积为![]() 。该步骤中发生的反应为
。该步骤中发生的反应为![]() ;计算装置C溶液中
;计算装置C溶液中![]() 与
与![]() 的物质的量浓度之比___(写出计算过程)。
的物质的量浓度之比___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某原子在处于能量最低状态时,外围电子排布为![]() ,则下列说法错误的是
,则下列说法错误的是
A. 该元素可能有+3价
B. 该元素位于第5周期副族
C. 该元素原子核外共有39个不同运动状态的电子
D. 该元素基态原子第N能层上还有5个空轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为主要原料合成一种具有果香味的物质 C 和化合物 D 的合成路线如图所示。
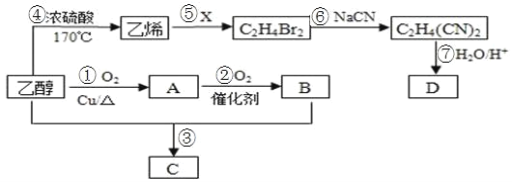
请回答下列问题:
(1)B的结构简式为_______。
(2)反应⑤的化学方程式为_______;B分子中的官能团名称为_______;反应⑥的类型为________。
(3)为了探究反应③的反应原理,通常采用“同位素示踪法”的方法,请结构简式为 CH3CH218OH,书写化反应③学方程式为_______。
(4)已知D的相对分子量为 118,其中碳、氢两元素的质量分数分别为 40.68%、5.08%,其余为氧元素,则 D 的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有油腻感,可做润滑剂。硼酸对人体受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
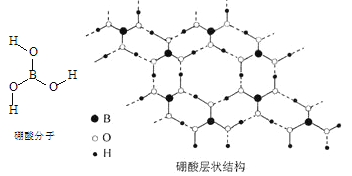
(1)B原子的结构示意图为_____________________;
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O![]() [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_________________________;
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_________________________;
(3)下列有关硼酸晶体的说法正确的是__________;
A.H3BO3分子的稳定性与氢键有关
B.含1 molH3BO3的晶体中有3 mol氢键
C.分子中B、O最外层均为8e-稳定结构
D.B原子杂化轨道的类型sp2,同层分子间的主要作用力是范德华力
(4)根据对角线规则,与B性质相似的元素是__________。
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是________;
A.HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=_____________;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数); _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是
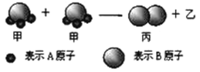
A.1个乙分子中含有2个A原子
B.该反应类型是分解反应
C.相对分子质量:Mr(甲)=Mr(乙)+Mr(丙)
D.该反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:

已知:反应I和反应II的平衡常数随温度变化曲线如图所示。
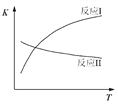
(1)反应I中,1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ。
① H2O的电子式是:_________________。
② 反应I的热化学方程式是:___________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
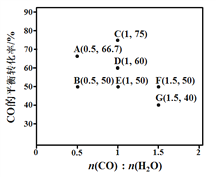
① 图中D、E两点对应的反应温度分别为TD和TE。判断:TD_______TE(填“<” “=”或“>”)。
② 经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的____相同。
③ 当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是______。
(3)反应III,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如下图所示。
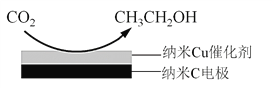
① 阴极的电极反应式是__________________________。
② 从电解后溶液中分离出乙醇的操作方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
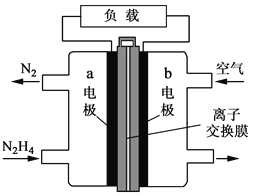
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵被广泛用于医药、干电池、织物印染、洗涤等领域。氯化铵T1温度下有以下平衡:![]()
(1)N原子最外层电子有______种运动状态;上述平衡中物质,在晶体时属于离子晶体的是__________。
(2)![]() 的电子式为______________。
的电子式为______________。
(3)Cl的非金属性强于S,用原子结构的知识说明理由:_________________。
(4)上述该反应的平衡常数表达式为____________________________________。
(5)在2L密闭容器中建立平衡,不同温度下氨气浓度变化正确的是_________。

(6)T1温度在2L,容器中,当平衡时测得![]() 为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得
为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得![]() 为bmol/L。试比较a与b的大小a_____b(填“>”“<”或“=”),并说明理由:___________。
为bmol/L。试比较a与b的大小a_____b(填“>”“<”或“=”),并说明理由:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com