
| A.离子化合物中一定含有离子键 |
| B.含有共价键的化合物一定是共价化合物 |
| C.强电解质与弱电解质的划分标准是电解质在水溶液中导电能力的强弱 |
| D.氧气中氧元素的化合价为0,所以氧分子中没有化学键 |
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
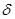 键与
键与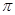 键的个数比为 。
键的个数比为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
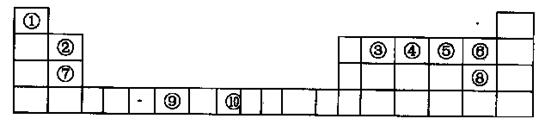
科目:高中化学 来源:不详 题型:填空题
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x 值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.先生成白色沉淀,加入足量氨水后沉淀消失 |
| B.生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
| C.生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl |
| D.若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后沉淀消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com