
【题目】常温下,向二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示。下列有关说法错误的是

A. 曲线M表示pH与lgc(HY-)/c(H2Y)的变化关系
B. Ka2(H2Y)=10-4.3
C. d点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)
D. 交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
【答案】D
【解析】
A.随着pH的增大,H2Y的电离程度逐渐增大,溶液中c(HY-)/c(H2Y)逐渐增大,c(HY-)/c(Y2-)逐渐减小,lgc(HY-)/c(H2Y)逐渐增大,lgc(HY-)/c(Y2-)逐渐减小,因此曲线M表示pH与lgc(HY-)/c(H2Y)的变化关系,故A正确;
B.pH=3时,lgc(HY-)/c(Y2-)=1.3,则Ka2(H2Y)=c(Y2-)c(H+)/c(HY-)=10-3/101.3=10-4.3,故B正确;
C.d点溶液中存在电荷守恒,c(H+)+c(K+)=2c(Y2-)+c(HY-)+c(OH-),因此c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+),故C正确;
D.交点e的溶液中存在lgc(HY-)/c(H2Y)=lgc(HY-)/c(Y2-)>1.3,因此c(HY-)/c(Y2-)>101.3,即c(HY-)>c(Y2-),故D错误。
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是

选项 | X | Y |
A. | MgSO4 | CuSO4 |
B. | AgNO3 | CuSO4 |
C. | FeSO4 | Al2(SO4)3 |
D. | CuSO4 | AgNO3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,下列描述错的是( )
A.AlON和石英的化学键类型相同B.电解熔融AlON可得到Al
C.AlON的N元素化合价为﹣1D.AlON和石英晶体类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.σ键一定比π键强度大
B.CO2溶于水和干冰升华都只有分子间作用力改变
C.缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体
D.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO2(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:____________________________。
②方法2:用氢氧化钠溶液将SO2转化为NaHSO3,再氧化为 Na2SO4。实验测得NaHSO3溶液中![]() = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(g) ![]() COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)
COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)![]() H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为
 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5 ℃,易水解。某学习小组在实验室中用下图所示装置制备ClNO。已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3===AgNO3+HNO2。
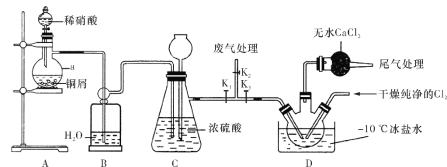
请回答下列问题:
(1)仪器a的名称为________,装置B的作用是________。
(2)装置A中发生反应的化学方程式为________。
(3)装置C中长颈漏斗的作用是________。
(4)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________时关闭K1、K2。向装置D三颈瓶中通入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO。
(5)装置D中干燥管的作用是________。
(6)ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:________(仅提供的试剂:1 mol·L-1盐酸、1 mol·L-1 HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②要验证ClNO与 H2O 反应后的溶液中存在Cl-和HNO2,合理的操作步骤及正确的顺序是________(填字母代号)。
a.向烧杯中滴加过量KI淀粉溶液,溶液变蓝色
b.取1.0 mL ClNO加入到盛有10.0 mL H2O的烧杯中,充分反应
c.向烧杯中滴加酸性KMnO4溶液,溶液紫红色褪去
d.向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。

(1)NO和NO2混合气体与NaOH溶液反应可以合成NaNO2,写出该反应的化学方程式___,生成1mol NaNO2时转移电子______mol
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为______和______,1mol该阴离子中所含的电子总数为______mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56 L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56 L。
①该反应中的氧化剂为______还原剂为______(填化学式)
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克______?(写出计算过程,保留一位小数,不考虑固体的体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中不正确的是
A. 某密闭容器中盛有0.2 mol SO2和0.1 mol O2,一定条件下充分反应,生成SO3分子数小于0.2 NA
B. 一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1 NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为 0.1 NA
D. 20g D2O中含有的质子数为10 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com