
| A. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成SO3分子数为0.2NA | |
| B. | 0.1 mol NH2-中含有的电子数为0.9NA | |
| C. | 3.4 g H2O2中含有的共用电子对数为0.1NA | |
| D. | 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
分析 A、二氧化硫和氧气的反应为可逆反应;
B、NH2-中含10个电子;
C、求出双氧水的物质的量,然后根据1mol双氧水中含18mol电子来分析;
D、氧气和臭氧均由氧原子构成.
解答 解:A、二氧化硫和氧气的反应为可逆反应,故不能进行彻底,故生成的三氧化硫分子个数小于0.2NA个,故A错误;
B、NH2-中含10个电子,故0.1molNH2-中含NA个电子,故B错误;
C、3.4g双氧水的物质的量为0.1mol,而1mol双氧水中含3mol共用电子对,故0.1mol双氧水中含0.3NA对共用电子对,故C错误;
D、氧气和臭氧均由氧原子构成,故16g混合物中含1mol氧原子,故含NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 体积相等pH=12的氨水和NaOH溶液中和盐酸的能力相同 | |
| B. | 室温下,向NH4HSO4溶液中加入NaOH溶液至中性,则c(SO42-)>c(Na+)>c(NH4+) | |
| C. | 物质的量浓度之比为1:2的CH3COOH和CH3COONa的混合溶液中:2c(CH3COO-)+2c(CH3COOH)=3c(Na+) | |
| D. | 向10ml 0.01mol/L AgNO3溶液中依次滴入2~3滴0.01mol/L NaCl溶液、0.01mol/L NaI溶液,所得沉淀由白色变成黄色,则可推知Kap(AgI)<Kap(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种复杂的混合物 | B. | 它由60个碳单质构成 | ||
| C. | 它是一种单质 | D. | 它是一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎把少量的浓硫酸沾在手上,应立即用大量水冲洗,然后涂上碳酸氢钠溶液 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 如果汽油、煤油等可燃物着火,应立即用水扑灭 | |
| D. | 酒精灯不慎碰翻着火,应立即用湿布盖灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.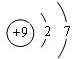 .
.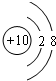 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L H2O所含的水分子数目为0.5NA | |
| B. | 16g O2和O3的混合气体中所含的氧原子数目为NA | |
| C. | 1.00mol/L Na2CO3溶液中所含Na+的数目为2NA | |
| D. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,产生H2数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
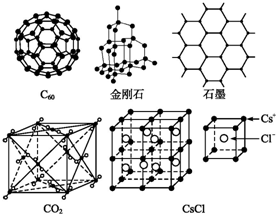
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com